Amin (hemija)
| Primarni amin | Sekundarni amin | Tercijarni amin |
|---|---|---|
 |
 |
 |
Amini pripadaju grupi organskih jedinjenja koja sadrže najmanje jednu ili više baznih azotovih atoma u molekulu. Amini se smatraju derivatima amonijaka i strukturno su mu sliči. Jedan ili više vodonikovih atoma zamijenjen sa jednom ili više alkilnih ili arilnih organskih grupa.[1] Važni amini su aminokiseline, trimetilamini, i anilini. Neorganski derivati amonijaka se takođe nazivaju aminima, npr. hloramin (NClH2).
Slični aminima su amidi, međutim oni su derivati karboksilnih kiselina i imaju karbonilnu grupu vezanu na amino skupinu, npr.: RC(O)NR2. Amidi i amini imaju različitu strukturu i svojstva, stoga je razlika u nazivu važna. Supstituent -NH2 se naziva amino grupa.[2] Jedinjenja sa atomom azota vezanim za karbonil grupu, koja imaju strukturu R–CO–NR′R″, se nazivaju amidima i imaju različita hemijska svojstva od amina.[3][4][5][6][7][8]
Nomenklatura amina
[уреди | уреди извор]Amini se mogu klasifikovati prema prirodi i broju supstituenata na azotu. Alifatični amini sadrže samo H i alkil supstituente. Aromatični amini imaju atom azota povezan sa aromatičnim prstenom.
Amini, podjednako alkilni i arilni, organizovani su u tri podkategorije [[#tabela_povezanosti_amino_grupa|(pogledajte tabelu)v] na osnovu broja atoma ugljenika u blizini azota (koliko je atoma vodonika u molekulu amonijaka zamenjeno ugljovodoničnim grupama):[2][9]
Kod nižih amina koristi se sufiks -amin, a kod viših amina koristi se prefiks amino-.
- Primarni amini: metilamin, etanolamin ili 2-aminoetanol
- Sekundarni amini: dimetilamin, dok bi primer aromatičnog amina bio difenilamin.
- Tercijarni amini: trimetilamin, dimetiletanolamin ili 2-(dimetilamin)etanol
Četvrta podkategorija je određena povezanošću supstituenata vezanih za azot:
- Ciklični amini — Ciklični amini su bilo sekundarni ili tercijarni amini. Primeri cikličnih amina su tročlani prsten aziridina i šestočlani prsten piperidina. N-metilpiperidin i N-fenilpiperidin su primeri cikličnih tercijarnih amina.
Isto tako je moguće da postoje četiri organska supstituenta na azotu. Ove vrste nisu amini već su kvaternarni amonijum katjoni i imaju naelektrisani azotni centar. Kvaternarne amonijum soli postoje sa mnogim vrstama anjona.
Konvencije imenovanja
[уреди | уреди извор]Amini se imenuju na nekoliko načina. Tipično, jedinjenju se daje prefiks „amino-” ili sufiks „-amin”. Prefiks N označava supstituciju na atomu azota (npr.: N,N-dimetiletilamin). Organsko jedinjenje sa više amino grupa naziva se diamin, triamin, tetraamin i tako dalje.
Niži amini se imenuju sufiksom -amin.

Viši amini imaju prefiks amino kao funkcionalnu grupu. IUPAC, međutim, ne preporučuje ovu konvenciju,[10] ali preferira oblik alkanamina, npr. butan-2-amin. 2-aminobutan (ili butan-2-amin)

Fizička svojstva
[уреди | уреди извор]Vodonična veza znatno utiče na svojstva amina[11], zbog toga je tačka ključanja viša nego kod sličnih alkana i niža od sličnih alkohola. Zbog veće elektronegativnosti kiseonika od azota, amini su više bazični od alkohola i alkana koji su time kiseliji. Amini manjih relativnih molekulskih masa (metil-, dimetil-, trimetil- i etilamin) su gasovi pri sobnoj temperaturi. Amini veće molekulske mase su tečnosti ili čvrste materije (dietilamin ili trietilamin).
Gasoviti amini imaju neugodan miris sličan amonijaku, dok tečni amini mirišu poput pokvarene ribe. Amini s manjim brojem ugljenikovih atoma dobro se rastvaraju u vodi stvarajući vodonične veze, rastvorljivost se smanjuje s povećanjem molekulske mase amina - odnosno hidrofobnog dela molekula. Alifatični amini dobro su rastvorni u organskim rastvaračima, pogotovo polarnim. Primarni amini reagiraju sa ketonima kao što je aceton.
Spektroskopska identifikacija
[уреди | уреди извор]Tipično se prisustvo aminske funkcionalne grupe određuje kombinacijom tehnika, uključujući masenu spektrometriju kao i NMR i IR spektroskopije. 1H NMR signali za amini nestaju nakon tretiranja uzorka sa D2O. U svom infracrvenom spektru primarni amini ispoljavaju dve N-H veze, dok sekundarni amini imaju samo jednu.[2][12]
Struktura
[уреди | уреди извор]Alifatični amini
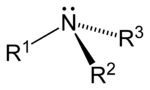
[уреди | уреди извор]Razlikuju se tri vrste amina: primarni, sekundarni i tercijarni, i to s obzirom na broj ugljovodoničnih grupa vezanih za azotov atom umjesto vodonika. Slovo R označava organsku (ugljovodoničnu) grupu.
Alkil amini karakteristično imaju tetraedralne azotne centre. C-N-C i C-N-H uglovi teže idealizovanom uglu 109°. C-N rastojanja su nešto kraća od C-C rastojanja. Energetska barijera barijera za azotnu inverziju stereoizomera je oko 7 kcal/mol za trialkilamin. Interkonverzija se može uporediti sa inverzijom otvorenog kišobrana na jakom vetru.
Amini tipa NHRR′ i NRR′R″ su hiralni: azotni centar nosi četiri supstituenta računajući slobodni par. Usled niske barijere inverzije, amini tipa NHRR′ se ne mogu dobiti u optički čistoj formi. Za hiralne tercijarne amine, NRR′R″ se jedino može rešiti kad su R, R′, i R″ grupe ograničene u cikličnim strukturama kao što su N-supstituisani aziridini (kvaternarne amonijum soli se mogu razdvojiti).

|
⇌ | 
|
| Inverzija amina. Par tačaka predstavlja usamljeni elektronski par na atomu azota. | ||
Aromatični amini
[уреди | уреди извор]Aromatični amini na azotovom atomu imaju vezan aromatični prsten, trivijalno se zovu anilini, primer je fenilamin. Anilin i njegovi derivati su u industrijskoj sintezi boja polazna jedinjenja. Aromatični prsten snižava bazičnost amina zavisno od supstituenata, a prisustvo amino grupe povećava reaktivnost kod aromatičnog prstena, zbog elektron-donatora. Jedna od reakcija aromatičnog prstena je Goldbergova reakcija.[13][14]
U aromatičnim aminima („anilinima”), azot je često skoro planaran usled konjugacije slobodnog elektronskog para sa aril substituentom. C-N rastojanje je respektivno kraće. U anilinu, C-N rastojanje je isto kao C-C rastojanja.[15]
Bazičnost
[уреди | уреди извор]Poput amonijaka, amini su baze.[16] U poređenju sa alkalnim metalnim hidroksidima, amini su slabi (pogledajte tabelu za primere Ka vrednosti konjugovanih kiselina).
| Alkilamin[17] or aniline[18] | pKa protonovanog amina | Kb |
|---|---|---|
| metilamin (MeNH2) | 10,62 | 4,17E-04 |
| dimetilamin (Me2NH) | 10,64 | 4,37E-04 |
| trimetilamin (Me3N) | 9,76 | 5,75E-05 |
| etilamin (EtNH2) | 10,63 | 4,27E-04 |
| anilin (PhNH2) | 4,62 | 4,17E-10 |
| 4-metoksianilin (4-MeOC6H4NH2) | 5,36 | 2,29E-09 |
| N,N-dimetilanilin (PhNMe2) | 5,07 | 1,17E-09 |
| 3-Nitroanilin (3-NO2-C6H4NH2) | 2,46 | 2,88E-12 |
| 4-Nitroanilin (4-NO2-C6H4NH2) | 1 | 1,00E-13 |
| 4-trifluorometilanilin (CF3C6H4NH2) | 2,75 | 5,62E-12 |
Bazičnost amina zavisi od:
- Elektronskioh svojstava supstituenata (alkil grupe povećavaju bazičnost, aril grupe smanjuju itd).
- Stepena solvacije protonisanog amina, čime su obuhvaćeni sterni efekti grupa na azotu.
Elektronski efekti
[уреди | уреди извор]Zahvaljujući induktivnim efektima, može se očekivati da se bazičnost amina povećava sa brojem alkil grupa na aminu. Korelacije su komplikovane zbog efekata solvatacije koji su suprotni trendovima induktivnih efekata. Efekti solvatacije takođe dominiraju bazičnost aromatičnih amina (anilina). Za aniline, usamljeni par elektrona na azotu se delokalizuje u prsten, što dovodi do smanjenja bazičnosti. Supstituenti na aromatičnom prstenu, i njihovi položaji u odnosu na amino grupu, takođe utiču na bazičnost kao što se vidi u tabeli.
Solvacioni efekti
[уреди | уреди извор]Solvatacija značajno utiče na bazičnost amina. N-H grupe formiraju jake interakcije sa vodom, a posebno amonijum joni. Nasuprot tome, bazičnost amonijaka se povećava za 1011 usled solvacije. Intrinzična bazičnost amina, tj. situacija u kojoj je solvatacija nevažna, je izučavana u gasnoj fazi. U gasnoj fazi amini pokazuju bazičnosti predviđene iz delovanja organskih supstituenata na oslobađanje elektrona. Tako su tercijarni amini u većoj meri bazični od sekundarnih amina, koji su više bazični od primarnih amina, i na kraju amonijak je najmanje bazičan. pKb redosled (bazičnosti u vodi) ne sledi ovaj trend. Slično tome anilin je više bazičan od amonijaka u gasnoj fazi, ali je deset hiljada puta manje bazičan u vodenom rastvoru.[19]
U aprotičnim polarnim rastvaračima kao što su DMSO, DMF, i acetonitril energija solvacije nije jednako visoka kao u protičnim rastvorima poput vode i metanola. Iz tog razloga, bazičnost amina u tim aprotičnim rastvaračima je skoro potpuno vođena elektronskim efektima.
Sinteza
[уреди | уреди извор]Alkilacija
[уреди | уреди извор]Najznačajniji industrijski postupak pripreme amina je putem alkilacije amonijaka alkoholima:[20]
- ROH + NH3 → RNH2 + H2O
Za razliku od reakcija amina sa alkil halidima, ovaj industrijski metod je zelen u smilu da se kao nusproizvod formira voda. Reakcija amina i amonijaka sa alkil halidima se koristi za laboratorijsku sintezu:
- RX + 2 R′NH2 → RR′NH + [RR′NH2]X
Takve reakcije, koje su najkorisnije za alkil jodide i bromide, retko se primenjuju jer je stepen alkilacije teško kontrolisati.[20] Selektivnost se može poboljšati putem Delepinove reakcije, mada se ona retko koristi u industrijskim razmerama.
Reduktivne rute
[уреди | уреди извор]Putem procesa hidrogenacije, nitrili se redukuju do amina koristeći vodonik u prisustvu nikla kao katalizatora. Reakcije su senzitivne za kisele i bazne uslove, što može da uzrokuje hidrolizu –CN grupe. LiAlH4 se češće koristi za redukciju nitrila u laboratorijskim razmerama. Slično tome, LiAlH4 redukuje amide do amina. Mnogi amini se formiraju iz aldehida i ketona putem reduktivne aminacije, koja se može odvijati bilo katalitički ili stehiometrijski.
Anilin (C6H5NH2) i njegov i derivati se pripremaju redukcijom nitroaromatičnih jedinjenja. U industriji, vodonik je preferentni reaktant, dok se u laboratorijskim uslovima često koriste kalaj i gvožđe.
Specijalizovane metode
[уреди | уреди извор]Postoje mnoge metode za pripremu amina, a mnoge od ovih metoda su prilično specijalizovane.
| Naziv reakcije | Supstrat | Komentar |
|---|---|---|
| Staudingerova redukcija | Organski azid | Ova reakcija se takođe odvija sa redukcionim agensom kao što je litijum aluminijum hidrid. |
| Šmitova reakcija | Karboksilna kiselina | |
| Aza-Bejlis-Hilmanova reakcija | Imin | Sinteza alilnih amina |
| Birčova redukcija | Imin | Korisno za reakcije koje hvataju nestabilne iminske intermedijere, kao što su Grignardove reakcije sa nitrilima.[21] |
| Hofmanova degradacija | Amid | Ova reakcija je validna samo za pripremu primarnih amina. Daje dobre prinose primarnih amina nezagađenih drugim aminima. |
| Hofmanova eliminacija | Kvaternarna amonijumova so | Nakon tretmana sa jakom bazom |
| Lukartova reakcija | Ketoni i aldehidi | Reduktivna aminacija mravljom kiselinom i amonijakom preko iminskog intermedijera |
| Hofman-Loflerova reakcija | Haloamin | |
| Ešvajler-Klarkova reakcija | Amin | Reduktivna aminacija mravljom kiselinom i formaldehidom preko iminskog intermedijera |
Reakcije
[уреди | уреди извор]Alkilacija, acilacija, i sulfonacija, itd
[уреди | уреди извор]Pored njihove bazičnosti, dominantna reaktivnost amina je njihova nukleofilnost.[22] Većina primarnih amina su dobri ligandi za metalne jone da formiraju koordinacione komplekse. Amini se alkiluju alkil halogenidima. Acil hloridi i anhidridi kiselina reaguju sa primarnim i sekundarnim aminima i formiraju amide („Šoten–Baumanova reakcija“).

Slično, sa sulfonil hloridima, dobijaju se sulfonamidi. Ova transformacija, poznata kao Hinsbergova reakcija, hemijski je test za prisustvo amina.
Pošto su amini bazni, oni neutrališu kiseline da bi formirali odgovarajuće amonijumove soli R
3NH+
. Kada se formiraju od karboksilnih kiselina i primarnih i sekundarnih amina, ove soli se termički dehidriraju i formiraju odgovarajuće amide.
Amini podležu sulfamaciji nakon tretmana sa sumpor trioksidom ili njegovim izvorima:
Diazotizacija
[уреди | уреди извор]Amini reaguju sa azotnom kiselinom dajući diazonijum soli. Alkil diazonijum soli su od malog značaja jer su previše nestabilne. Najvažniji članovi su derivati aromatičnih amina kao što je anilin („fenilamin”) (A = aril ili naftil):
Anilini i naftilamini formiraju stabilnije diazonijum soli, koje se mogu izolovati u kristalnom obliku.[23] Diazonijum soli prolaze kroz niz korisnih transformacija koje uključuju zamenu N
2 grupa sa anjonima. Na primer, cijanid bakra daje odgovarajuće nitrile:
Arildiazonijumi se spajaju sa aromatičnim jedinjenjima bogatim elektronima kao što je fenol da bi formirali azo jedinjenja. Takve reakcije se široko primenjuju u proizvodnji boja.[24]
Konverzija u imine
[уреди | уреди извор]Formiranje imina je važna reakcija. Primarni amini reaguju sa ketonima i aldehidima, i formiraju imine. U slučaju formaldehida (R' = H), ovi proizvodi obično postoje kao ciklični trimeri: Redukcija ovih imina daje sekundarne amine:
Slično, sekundarni amini reaguju sa ketonima i aldehidima da bi formirali enamine:
Živini joni reverzibilno oksidiraju tercijarne amine sa α vodonikom do iminijum jona:[25]
Pregled
[уреди | уреди извор]U nastavku je dat pregled reakcija amina:
Biološka aktivnost
[уреди | уреди извор]Amini su sveprisutni u biologiji. Razlaganjem aminokiselina oslobađaju se amini, što je poznato u slučaju raspadajućih riba koje mirišu na trimetilamin. Mnogi neurotransmiteri[26] su amini, uključujući epinefrin, norepinefrin, dopamin, serotonin i histamin. Protonisane amino grupe (–NH+
3) su najčešći pozitivno naelektrisani delovi u proteinima, posebno u aminokiselini lizin.[27] DNK anjonskog polimera je tipično vezan za različite proteine bogate aminom.[28] Dodatno, terminalno naelektrisani primarni amonijum na lizinu formira sone mostove sa karboksilatnim grupama drugih amino kiselina u polipeptidima, što je jedan od primarnih uticaja na trodimenzionalne strukture proteina.[29]
Aminski hormoni
[уреди | уреди извор]Hormoni dobijeni modifikacijom aminokiselina nazivaju se aminskim hormonima. Tipično, originalna struktura aminokiseline je modifikovana tako da se ukloni –COOH, ili karboksilna grupa, dok –NH+
3, ili amino grupa ostaje. Aminski hormoni se sintetišu iz aminokiselina triptofana ili tirozina.[30]
Primena amina
[уреди | уреди извор]Boje
[уреди | уреди извор]Primarni aromatični amini se koriste kao polazni materijal za proizvodnju azo boja. Oni reaguju sa azotnom kiselinom da bi se formirala diazonijumova so, koja se može podvrgnuti reakciji kuplovanja u kojoj nastaju azo jedinjenje. Azo jedinjenja su jarko obojena, te se ona široko koriste u industriji bojenja. Primeri takvih jedinjenja su:
- Metil orindž
- Direktno braon 138
- Sanset žuto FCF
- Ponso
Lekovi
[уреди | уреди извор]Većina lekova i kandidata za lekove sadrže aminske funkcionalne grupe:[31]
- Hlorfeniramin je antihistaminik koji pomaže u ublažavanju alergijskih poremećaja usled prehlade, polenske groznice, svraba kože, ujeda insekata i uboda.
- Hlorpromazin je sredstvo za smirenje koje umiruje bez izazivanja sna. Koristi se za ublažavanje anksioznosti, uzbuđenja, nemira ili čak mentalnog poremećaja.
- Efedrin i fenilefrin, kao amin hidrohloridi, koriste se kao dekongestivi.
- Amfetamin, metamfetamin i metkatinon su psihostimulativni amini koje je američka DEA navela kao kontrolisane supstance.
- Tioridazin, antipsihotik, je amin za koji se veruje da ispoljava svoje antipsihotičke efekte, delimično, zbog efekata na druge amine.[32]
- Amitriptilin, imipramin, lofepramin i klomipramin su triciklični antidepresivi i tercijarni amini.
- Nortriptilin, dezipramin i amoksapin su triciklični antidepresivi i sekundarni amini. (Triciklične grupe su grupisane po prirodi konačne amino grupe na bočnom lancu.)
- Supstituisani triptamini i fenetilamini su ključne osnovne strukture za veliki broj psihodeličnih lekova.
- Opijatni analgetici kao što su morfijum, kodein i heroin su tercijarni amini.
Tretman gasom
[уреди | уреди извор]Vodeni monoetanolamin (MEA), diglikolamin (DGA), dietanolamin (DEA), diizopropanolamin (DIPA) i metildietanolamin (MDEA) se široko koriste u industriji za uklanjanje ugljen-dioksida (CO2) i vodonik sulfida (H2S) iz prirodnog gasa i rafinerijskih tokova procesa. Takođe se mogu koristiti za uklanjanje CO2 iz gasova sagorevanja i dimnih gasova i mogu imati potencijal za smanjenje gasova staklene bašte. Povezani procesi su poznati kao zaslađivanje.[33]
Sredstva za očvršćavanje epoksidne smole
[уреди | уреди извор]Amini se često koriste kao sredstva za očvršćavanje epoksidne smole.[34][35] To uključuje dimetiletilamin, cikloheksilamin i razne diamine kao što je 4,4-diaminodicikloheksilmetan.[20] Multifunkcionalni amini kao što su tetraetilenpentamin i trietilentetramin se takođe široko koriste u ovom svojstvu.[36] Reakcija se nastavlja tako što usamljeni par elektrona na aminskom azotu napada najudaljeniji ugljenik na oksiranskom prstenu epoksidne smole. Ovo ublažava opterećenje prstena na epoksidu i predstavlja pokretačku snagu reakcije.[37] Molekuli sa funkcionalnošću tercijarnog amina se često koriste za ubrzavanje reakcije očvršćavanja epoksi-amina i uključuju supstance kao što je 2,4,6-tris(dimetilaminometil)fenol. Navedeno je da je ovo najrasprostranjeniji akcelerator sobne temperature za dvokomponentne sisteme epoksidne smole.[38][39]
Bezbednost
[уреди | уреди извор]Prosti amini male molekularne težine, kao što je etilamin, su samo slabo toksični sa LD50 između 100 i 1000 mg/kg. Oni iritiraju kožu, posebno zato što se neki lako apsorbuju kroz kožu.[20] Amini su široka klasa jedinjenja, a složeniji članovi klase mogu biti izuzetno bioaktivni, na primer strihnin.
Neke vrste amina
[уреди | уреди извор]Alkaloidi
[уреди | уреди извор]Alkaloidi su amini u prirodi, posebno u biljnom svetu. U prirodi većinom nastaju iz aminokiselina. Znatan broj alkaloida je otrovan, gorkog ukusa s vrlo jakim farmakološkim učinkom. Primeri alkaloida: kofein (nalazi se u kafi, čaju, bezalkoholnim pićima, letalna doza kofeina je 10 grama), nikotin (nalazi se u lišću duhana, letalna doza nikotina je 500 miligrama (u krvotoku)), morfin (nalazi se u opijumu, osušenom soku iz maka).
Triptamini
[уреди | уреди извор]Triptamini su alkaloidni monoamini. Stvaraju se oko indolnog prstena. Odgovaraju aminokiselini triptofan. Neki deluju kao neurotransmiteri, a neki kao halucinogeni (psihoaktivne droge, psihodelične droge). Primeri triptamina: serotonin, melatonin, dimetiltriptamin, psilocin. Droge vrste triptamina se nalaze u porodici (TiHKAL).
Feniletilamini
[уреди | уреди извор]Feniletilamini su alkaloidni monoamini. Odgovaraju aminokiselini fenilalanin. Supstituisani feniletilamini su jedinjenja sa mnoštvom funkcija: neurotransmiteri, hormoni, stimulanti, halucinogeni, antidepresivi. Primeri feniletilamina: dopamin, adrenalin, noradrenalin, amfetamin, metamfetamin, meskalin, MDMA, tiramin, salbutamol. Druge vrste feniletilamina se nalaze u porodici (PiHKAL).
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ а б в Smith, Janice Gorzynski (2011). „Chapter 25 Amines”. Ур.: Hodge, Tami; Nemmers, Donna; Klein, Jayne. Organic chemistry (на језику: енглески) (3rd изд.). New York, NY: McGraw-Hill. стр. 949—993. ISBN 978-0-07-337562-5. Архивирано из оригинала (Book) 28. 06. 2018. г. Приступљено 12. 05. 2019.
- ^ Harrison L. G. : The shaping of life: The generation of biological pattern. . Cambridge University Press. 2011. ISBN 978-0-521-55350-6. Недостаје или је празан параметар
|title=(помоћ); http://books.google.com/books?id=-IPG-vg7Pr8C. - ^ Hadžiselimović R., Pojskić N. : Uvod u humanu imunogenetiku. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. . 2005. ISBN 978-9958-9344-3-8 [http://books.google.com/books?id=-IPG-vg7Pr8C.
- %5b%5b#cite_ref-5|^%5d%5d Hadžiselimović http://books.google.com/books?id=-IPG-vg7Pr8C.
- [[#cite_ref-5|^]] Hadžiselimović] Проверите вредност параметра
|url=(помоћ). line feed character у|url=на позицији 54 (помоћ); Недостаје или је празан параметар|title=(помоћ); Сукоб URL—викивеза (помоћ) - ^ Alberts B. ː Molecular biology of the cell. Garland Science. . New York. 2002. ISBN 978-0-8153-3218-3. Недостаје или је празан параметар
|title=(помоћ) - ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. : Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2005. ISBN 978-9958-9344-1-4.
- ^ Kapur Pojskić L., Ed. : Uvod u genetičko inženjerstvo i biotehnologiju, 2. izdanje. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo. 2014. ISBN 978-9958-9344-8-3.
- ^ „3.11 Basic properties of amines”. Chemistry LibreTexts (на језику: енглески). 2015-09-28. Архивирано из оригинала 23. 5. 2021. г. Приступљено 2021-05-23.
- ^ Hellwich, K.-H.; Hartshorn, R. M.; Yerin, A.; Damhus, T.; Hutton, A. T. (јун 2021). „Brief Guide to the Nomenclature of Organic Chemistry” (PDF). The International Union of Pure and Applied Chemistry (IUPAC). Приступљено 2024-03-07.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Smith, Brian (март 2019). „Organic Nitrogen Compounds II: Primary Amines”. Spectroscopy. Spectroscopy-03-01-2019. 34: 22—25. Приступљено 12. 2. 2024.
- ^ Ullmann, Fritz (1905). „Ueber die Phenylirung von Phenolen”. Berichte der deutschen chemischen Gesellschaft. 38 (2): 2211—2212. doi:10.1002/cber.190503802176.
- ^ Irma Goldberg (1906). „Ueber Phenylirungen bei Gegenwart von Kupfer als Katalysator”. Berichte der deutschen chemischen Gesellschaft. 39 (2): 1691—1692. doi:10.1002/cber.19060390298.
- ^ G. M. Wójcik, 2007, "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. Weinheim: Wiley-VCH. doi:10.1002/9780470682531.pat0385.
- ^ Smith, J. W. (1968). S. Patai, ур. „Basicity and complex formation”. Patai's Chemistry of Functional Groups. doi:10.1002/9780470771082.ch4.
- ^ Hall, H. K. (1957). „Correlation of the Base Strengths of Amines”. Journal of the American Chemical Society. 79 (20): 5441—5444. doi:10.1021/ja01577a030.
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). „Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales”. The Journal of Organic Chemistry. 70 (3): 1019—1028. PMID 15675863. doi:10.1021/jo048252w.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ а б в г Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_001.
- ^ Weiberth, Franz J.; Hall, Stan S. (1986). „Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines”. Journal of Organic Chemistry. 51 (26): 5338—5341. doi:10.1021/jo00376a053.
- ^ March, Jerry (1992), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (4th изд.), New York: Wiley, ISBN 0-471-60180-2
- ^ A. N. Nesmajanow (1943). „β-Naphthylmercuric chloride”. Org. Synth.; Coll. Vol., 2, стр. 432
- ^ Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (2000). „Azo Dyes”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a03_245.
- ^ Williams, D. L. H. (1988). Nitrosation
. Cambridge, UK: Cambridge University. стр. 195. ISBN 0-521-26796-X.
- ^ Cuevas J (2019-01-01). „Neurotransmitters and Their Life Cycle”. Reference Module in Biomedical Sciences. Elsevier. ISBN 978-0-12-801238-3. doi:10.1016/b978-0-12-801238-3.11318-2.
- ^ Andrade, Miguel A.; O'Donoghue, Seán I.; Rost, Burkhard (1998). „Adaptation of protein surfaces to subcellular location”. Journal of Molecular Biology. 276 (2): 517—25. CiteSeerX 10.1.1.32.3499
. PMID 9512720. doi:10.1006/jmbi.1997.1498.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry
(3rd изд.). New York: Worth Publishing. ISBN 1-57259-153-6.
- ^ Dill, Ken A. (1990). „Dominant forces in protein folding”. Biochemistry. 29 (31): 7133—55. PMID 2207096. S2CID 30690389. doi:10.1021/bi00483a001.
- ^ Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (26. 7. 2023). Anatomy & Physiology. Houston: OpenStax CNX. 17.2 Hormones. ISBN 978-1-947172-04-3.
- ^ Roughley, Stephen D.; Jordan, Allan M. (2011). „The Medicinal Chemist's Toolbox: An Analysis of Reactions Used in the Pursuit of Drug Candidates”. Journal of Medicinal Chemistry. 54 (10): 3451—3479. PMID 21504168. doi:10.1021/jm200187y.
- ^ American Society of Health System Pharmacists; AHFS Drug Information 2010. Bethesda, MD. (2010), p. 2510
- ^ Hammer, Georg; Lübcke, Torsten; Kettner, Roland; Davis, Robert N.; Recknagel, Herta; Commichau, Axel; Neumann, Hans-Joachim; Paczynska-Lahme, Barbara (2000). „Natural Gas”. Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a17_073.
- ^ „amine curing agent: Topics by Science.gov”. science.gov (на језику: енглески). Приступљено 2022-03-01.
- ^ Howarth, Graham (1995-01-01). „The use of water-based epoxies for anti-corrosive primers”. Pigment & Resin Technology. 24 (6): 3—6. ISSN 0369-9420. doi:10.1108/eb043156.
- ^ Eller K, Henkes E, Rossbacher R, Höke H (2005). „Amines, Aliphatic”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 3527306730. doi:10.1002/14356007.a02_001.
- ^ Howarth G.A "Synthesis of a legislation compliant corrosion protection coating system based on urethane, oxazolidine and waterborne epoxy technology" pages 12, Chapter 1.3.1 Master of Science Thesis April 1997 Imperial College London
- ^ Seo, Jiae; Yui, Nobuhiko; Seo, Ji-Hun (јануар 2019). „Development of a supramolecular accelerator simultaneously to increase the cross-linking density and ductility of an epoxy resin”. Chemical Engineering Journal. 356: 303—311. Bibcode:2019ChEnJ.356..303S. ISSN 1385-8947. doi:10.1016/j.cej.2018.09.020.
- ^ Chen, Fengjun; Liu, Fan; Du, Xiaogang (2023-01-10). „Molecular dynamics simulation of crosslinking process and mechanical properties of epoxy under the accelerator”. Journal of Applied Polymer Science (на језику: енглески). 140 (2). ISSN 0021-8995. doi:10.1002/app.53302.
Literatura
[уреди | уреди извор]- „Amines | Introduction to Chemistry”. courses.lumenlearning.com. Приступљено 2021-07-22.
- Flick, Ernest W. (1993). Epoxy Resins, Curing Agents, Compounds, and Modifiers: An Industrial Guide. Park Ridge, NJ: Noyes Publications. ISBN 978-0-8155-1708-5. OCLC 915134542.
- Santos, M.H.Silla (1996). „Biogenic amines: their importance in foods”. International Journal of Food Microbiology. 29 (2–3): 213—231. PMID 8796424. doi:10.1016/0168-1605(95)00032-1.
- Burchett SA, Hicks TP (август 2006). „The mysterious trace amines: protean neuromodulators of synaptic transmission in mammalian brain”. Prog. Neurobiol. 79 (5–6): 223—46. PMID 16962229. S2CID 10272684. doi:10.1016/j.pneurobio.2006.07.003.
- Suzzi G, Torriani S (2015). „Editorial: Biogenic amines in foods”. Front Microbiol. 6: 472. PMC 4435245
. PMID 26042107. doi:10.3389/fmicb.2015.00472
.
- Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (6. 7. 2023). Anatomy & Physiology. Houston: OpenStax CNX. 12.5 Communication between neurons. ISBN 978-1-947172-04-3.
- Vanda, Pereira (17. 2. 2017). „Analytical methodologies for the determination of biogenic amines in wines: an overview of the recent trends”. Journal of Analytical, Bioanalytical and Separation Techniques (на језику: енглески). 2 (1). doi:10.15436/2476-1869.17.1296.
- „Definition of AMMINE”. www.merriam-webster.com (на језику: енглески). Приступљено 2024-06-27.
- A. von Zelewsky "Stereochemistry of Coordination Compounds" John Wiley: Chichester, 1995. ISBN 0-471-95599-X.
- Werner, Alfred (1893). „Beitrag zur Konstitution anorganischer Verbindungen”. Zeitschrift für Anorganische Chemie. 3: 267—330. doi:10.1002/zaac.18930030136.
- "Werner Centennial" George B. Kauffman, Ed. Adv. Chem. Ser., 1967, Volume 62. ISBN 978-0-8412-0063-0
- Huheey, James E. (1983). Inorganic Chemistry (3rd изд.). стр. 360.
- Atoji, M.; Richardson, J. W.; Rundle, R. E. (1957). „On the Crystal Structures of the Magnus Salts, Pt(NH3)4PtCl4”. J. Am. Chem. Soc. 79 (12): 3017—3020. doi:10.1021/ja01569a009.
- Laurence, C. and Gal, J-F. Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50–51 ISBN 978-0-470-74957-9
- Cramer, R. E.; Bopp, T. T. (1977). „Graphical display of the enthalpies of adduct formation for Lewis acids and bases”. Journal of Chemical Education. 54: 612—613. doi:10.1021/ed054p612. The plots shown in this paper used older parameters. Improved E&C parameters are listed in ECW model.
- Hair, Neil J.; Beattie, James K. (1977). „Structure of Hexaaquairon(III) Nitrate Trihydrate. Comparison of Iron(II) and Iron(III) Bond Lengths in High-Spin Octahedral Environments”. Inorganic Chemistry. 16 (2): 245—250. doi:10.1021/ic50168a006.
Dodatna literatura
[уреди | уреди извор]- „The Biogenic Amines”. – Neuroscience 2nd edition, Dale Purves et al.
Spoljašnje veze
[уреди | уреди извор]- Sinteza primarnih amina - Sintetički protokoli
- Synthesis of amines
- Factsheet, amines in food Архивирано 19 фебруар 2018 на сајту Wayback Machine