Галијум
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Општа својства | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | галијум, Ga | |||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | сребрнасто плав | |||||||||||||||||||||||||||||||||||||||||||||||
| У периодноме систему | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број (Z) | 31 | |||||||||||||||||||||||||||||||||||||||||||||||
| Група, периода | група 13 (борова група), периода 4 | |||||||||||||||||||||||||||||||||||||||||||||||
| Блок | p-блок | |||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | постпрелазни метал | |||||||||||||||||||||||||||||||||||||||||||||||
| Рел. ат. маса (Ar) | 69,723(1)[1] | |||||||||||||||||||||||||||||||||||||||||||||||
| Ел. конфигурација | ||||||||||||||||||||||||||||||||||||||||||||||||
по љускама | 2, 8, 18, 3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Физичка својства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Тачка топљења | 302,9146 K (29,7646 °C, 85,5763 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Тачка кључања | 2673 K (2400 °C, 4352 °F)[2] | |||||||||||||||||||||||||||||||||||||||||||||||
| Густина при с.т. | 5,91 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| течно ст., на т.т. | 6,095 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Топлота фузије | 5,59 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Топлота испаравања | 256 kJ/mol[2] | |||||||||||||||||||||||||||||||||||||||||||||||
| Мол. топл. капацитет | 25,86 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||
Напон паре
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомска својства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | 1,81 | |||||||||||||||||||||||||||||||||||||||||||||||
| Енергије јонизације | 1: 578,8 kJ/mol 2: 1979,3 kJ/mol 3: 2963 kJ/mol (остале) | |||||||||||||||||||||||||||||||||||||||||||||||
| Атомски радијус | 135 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентни радијус | 122±3 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Валсов радијус | 187 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Остало | ||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | орторомбична | |||||||||||||||||||||||||||||||||||||||||||||||
| Брзина звука танак штап | 2740 m/s (на 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Топл. ширење | 18 µm/(m·K) (на 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Топл. водљивост | 40,6 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Електроотпорност | 270 nΩ·m (на 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнетни распоред | дијамагнетичан | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | −21,6·10−6 cm3/mol (на 290 K)[3] | |||||||||||||||||||||||||||||||||||||||||||||||
| Јангов модул | 9,8 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов коефицијент | 0,47 | |||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдоћа | 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Бринелова тврдоћа | 56,8–68,7 MPa | |||||||||||||||||||||||||||||||||||||||||||||||
| CAS број | 7440-55-3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Историја | ||||||||||||||||||||||||||||||||||||||||||||||||
| Именовање | по лат. Gallia-и (латински за: Француска), постојбини овог открића | |||||||||||||||||||||||||||||||||||||||||||||||
| Предвиђање | Дмитриј Мендељејев (1871) | |||||||||||||||||||||||||||||||||||||||||||||||
| Откриће и прва изолација | Пол Емил Лекок де Буабодран (1875) | |||||||||||||||||||||||||||||||||||||||||||||||
| Главни изотопи | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Галијум (Ga, лат. gallium) метал је IIIA групе. Има 4 изотопа од којих су постојани 69 i 71.[4][5] Заступљен је у земљиној кори у количини од 18 ppm као пратилац руда бакра и цинка. Чисти галијум је сребрнасто сјајни метал, који не реагује са водом и кисеоником. Једињења галијума боје пламен у љубичасто. Пол Емил Лекок де Буабодран га је открио 1875.
Галијум се не кристализира у неку од обичних кристалних структура како је то уобичајено код метала, већ у своју најстабилнију модификацију, једну орторомпску структуру са галијумовим димерима. Поред тога, познато је још шест модификација, које се јављају у посебним условима кристализације или под великим притиском. По хемијским особинама, галијум је сличан алуминијуму. У природи, може се наћи само у ограниченим количинама, углавном у смеси са алуминијевим, цинковим или германијумовим рудама. Галијумови минерали су врло ретки. Због тога, он се добија искључиво као споредни производ у производњи алуминијума или цинка. Највећи део галијума се користи у виду галијум арсенида, као полупроводник за производњу светлећих диода.
Флуориди и фосфорити галијума имају особине полупроводника и они се додају силицијуму који се користи у електроиндустрији. Слојеви галијум-арсеника се користе за израду ултрабрзих процесора. Метални галијум се користи за пуњење термометара који мере високе температуре. Овај елемент нема познатог биолошког значаја.
Историја
[уреди | уреди извор]Постојање елемента који би одговарао галијуму је предсказао Дмитриј Иванович Мендељејев 1871. године. Он је предвидео, након усавршавања свог периодног система елемената, нови елемент ека-алуминијум, којем је предвидео сличне особине са алуминијумом (атомску масу, специфичну тежину, тачку топљења, врсту соли које гради и слично).[6]
Француски хемичар Пол Емил Лекок де Буабодран, који није био упознат са Мендељејевљевим предвиђањима, пронашао је да у следу линија линијског спектра важе одређене законитости, те је покушао да то потврди за алуминијум и сличне елементе. При томе је открио да између алуминијума и индијума мора стајати још један непознати елемент. Напокон 1875. године он је успео да открије две љубичасте спектралне линије, након што је растворио цинкове минерале у киселини.[7]
На крају, Лекок де Буабодран је успео да из неколико стотина килограма минерала цинка издвоји релативно знатну количину галијум хидроксида. Из њега је путем растварања у раствор калијум карбоната и електролизе први пут добио елементарни галијум.[7]
О пореклу имена галијум постоје две теорије. По првој, Буабодран је дао име елементу по Галији, латинском имену његове домовине Француске. По другој теорији, из латинске речи gallus (кокош) као извору имена, што одговара француској речи Le Coq. По тој теорији, Пол Емил Лекок де Буабодран је дао име елементу по свом имену.[8]
Након што су измерене и откривене особине новог елемента, Мендељејев је врло брзо схватио, да се ради о ека-алуминијуму чије је постојање он предвидео. Многе особине је веома тачно израчунао. Тако је на пример Мендељејев израчунао да би ека-алуминијум требао да има густину од 5,9 што је веома мало одступање од доказане вредности 5,94.[7]
Особине
[уреди | уреди извор]Физичке
[уреди | уреди извор]
Галијум је сребрено-сјајни, меки метал (по Мосовој скали 1,5[9]). Он има, за метале неуобичајену, веома ниску тачку топљења која износи 29,76 °C. По томе је, после живе и цезијума, метал са најнижом тачком топљења, далеко нижом у односу на суседне елементе у периодном систему: алуминијум и индијум. Сматра се да је за овако ниску тачку топљења одговорна неуобичајена кристална структура, која нема строге симетрије те стога није ни стабилна за разлику од већине других метала.[10] Пошто тачка кључања галијума износи 2204 °C, температурно подручје у којем је галијум у течном стању је изузетно широко. Галијум поседује особину аномалије густине, попут силицијума, неких других елемената и воде, његова густина у течном стању је за 3,2%[11] већа него у чврстом стању. Ова особина је карактеристична за материјале који имају молекуларне везе у чврстом стању.[12]
Галијум у чврстом стању је дијамагнетичан, међутим када пређе у течно стање постаје парамагнетичан = 2,4 · 10−6 на температури од 40 °C.[13]
Карактеристично за његове структуре је стварање веза галијум-галијум. Познате су различите модификације, које се формирају под различитим условима кристализације (познате су четири модификације под нормалним притиском од α- до δ-галијума, док се под притиском формирају три модификације Ga-II, Ga-III, Ga-IV). На собној температури најстабилнија модификација је α-галијум који се кристализује у орторомпској слојевитој структури. При томе два атома цезијума чине димер тако што се вежу један с другим путем ковалентне везе. Сваки атом галијума граничи са додатних шест атома других димера. Између појединих димера владају металне везе. Димери галијума су толико стабилни, да су повезани један с другим чак и при топљењу, а може се доказати њихово постојање и у гасовитом стању.[14]
Остале модификације се стварају при кристализацији потхлађеног, течног галијума. На температури од −16,3 °C ствара се β-галијум који има моноклинску кристалну структуру. У тој структури галијумови атоми су наизменично поређани паралелно у цик-цак формацији. Ако се кристализација одвија на температури од −19,4 °C, формира се тригонални δ-галијум, у којем се, попут α-бора, формирају икосаедри од дванаест атома. Они су повезани један с другим преко појединачних атома галијума. На температури од −35,6 °C формира се γ-галијум. У овој орторомпској модификацији формирају се цеви од међусобно повезаних Ga7 прстенова у чијој средини се налази праволинијски ланац галијумових атома.[14]
Уколико се галијум изложи високом притиску на собној температури, стварају се различите модификације. На 30 kbar[14] стабилна је кубна модификација галијум-II, код које се сваки атом окружује са додатих осам атома. Ако се притисак повећа на 140 kbar, метал се кристализује као тетрагонални галијум-III, у структуру која одговара индијуму.[15] Даље, ако се притисак повећа на око 1200 kbar, формира се кубична површинско центрирана структура галијума-IV.[15]
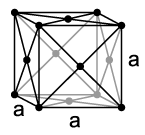
| Модификација | α-Ga[16] | β-Ga[17] | γ-Ga[18] | δ-Ga[19] | галијум-II[20] | галијум-III[20] | галијум-IV[15] |
|---|---|---|---|---|---|---|---|
| Структура |  |
 |
 |
 |
 |
 |
|
| Кристални систем | орторомпски | моноклински | орторомпски | тригонални | кубни | тетрагонални | кубни |
| Координациони број | 1+6 | 8 (2+2+2+2) | 3, 6–9 | 6–10 | 8 | 4+8 | 12 |
| Просторна група | |||||||
| Параметар решетке | a = 452,0 pm b = 766,3 pm c = 452,6 pm |
a = 276,6 pm b = 805,3 pm c = 333,2 pm β = 92° |
a = 1060 pm b = 1356 m c = 519 pm |
a = 907,8 pm c = 1702 pm |
a = 459,51 pm |
a = 280,13 pm c = 445,2 pm |
a = 408 pm |
| Атома по елементарној ћелији | 8 | 8 | 40 | 66 | 12 | 3 | 4 |
Хемијске
[уреди | уреди извор]Хемијске особине галијума сличне су особинама алуминијума. Попут њега, галијум је пасивизиран када је изложен ваздуху, стварањем густог слоја оксида на површини метала, те не реагује. Тек при високом притиску и у контакту са чистим кисеоником, метал сагорева светлим пламеном стварајући оксид. Слично, не реагује ни са водом, јер се штити нерастворљивим слојем галијум-хидроксида. Али ако се галијум легира са алуминијумом, те се тако снизи тачка топљења и на собној температури постаје течан, врло бурно реагује с водом. Са халогеним елементима галијум реагује брзо стварајући одговарајућу со GaX3.
Галијум је амфотеран и растворљив је и у киселинама и у базама истискујући из њих водоник. У базама, аналогно са алуминијумовим солима, граде се Ga3+-јони, а у базама галати у облику [Ga(OH)4]−. У разблаженим киселинама полако се раствара, а у царској води и концентрованој соди много брже. Деловањем азотне киселине галијум се пасивизира.
-
- Reakcija galijuma sa sodom
Течни галијум напада већину метала, тако да се он може чувати само у посудама од кварца, стакла, графита, алуминијум оксида, волфрама до 800 °C и тантала до 450 °C.[21]
Изотопи
[уреди | уреди извор]Постоји укупно 30 изотопа галијума између 56Ga и 86Ga и додатних седам нуклеарних изомера. Од њих су два стабилна: 69Ga и 71Ga и јављају се у природи. У природној смеши изотопа преовладава 69Ga са уделом од 60,12% док остатак од 39,88% отпада на 71Ga. Међу нестабилним изотопима 67Ga има најдуже време полураспада од 3,26 дана, док код осталих изотопа време полураспада се креће од неколико секунди до највише 14,1 сати код изотопа 72Ga.[22]
Два изотопа галијума, 67Ga и краткоживећи 68Ga са временом полураспада од 67,71 минута се користе у нуклеарној медицини као трејсери за томографију емисијом позитрона. Изотоп 67Ga се за ту сврху производи у циклотрону док за производњу изотопа 68Ga није потребан циклотрон. Уместо тога добија се озрачивањем 69Ga путем дугоживућег изотопа германијума 68Ge уз емисију протона. Он се даље распада на 68Ga из чега се даље 68Ga екстрактује помоћу посебног генератора. За потребе испитивања галијум је, по правилу, везан у једном комплексу са јаким желатинозним лигандом као што је 1,4,7,10-тетраазациклододекан-1,4,7,10-тетра ацетатна киселина (ДОТА).[23]
Референце
[уреди | уреди извор]- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ а б Zhang Y; Evans JRG; Zhang S (2011). „Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks”. J. Chem. Eng. Data. 56 (2): 328—337. doi:10.1021/je1011086.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ^ William H. Brock (1997). Viewegs Geschichte der Chemie. Braunschweig: Vieweg. стр. 206—207. ISBN 3-540-67033-5.
- ^ а б в Mary Elvira Weeks (2003). Discovery of the Elements (3 изд.). Kessinger Publishing. стр. 215—219. ISBN 978-0-7661-3872-8.
- ^ R. R. Moskalyk (2003). „Gallium: the backbone of the electronics industry”. Minerals Engineering. 16 (10): 921—929. doi:10.1016/j.mineng.2003.08.003.
- ^ Helmut Sitzmann: Gallium. u: Römpp Chemie Lexikon. Thieme Verlag, decembar 2006.
- ^ Ulrich Müller (2008). Anorganische Strukturchemie (6 изд.). Vieweg+Teubner Verlag. стр. 228. ISBN 978-3-8348-0626-0.
- ^ J. F. Greber (2005). „Gallium and Gallium Compounds”. Ullmann's Encyclopedia of Industrial Chemistry (7 изд.). Weinheim: Wiley-VCH.
- ^ O. Züger; U. Dürig (1992). „Atomic structure of the α-Ga(001) surface investigated by scanning tunneling microscopy: Direct evidence for the existence of Ga2 molecules in solid gallium”. Phys. Rev. B. 46: 7319—7321. doi:10.1103/PhysRevB.46.7319.
- ^ Weast, Robert C., ур. (1990). CRC Handbook of Chemistry and Physics. Boca Raton: CRC (Chemical Rubber Publishing Company). стр. E—129 do E—145. ISBN 0-8493-0470-9.
- ^ а б в Arnold F. Holleman; Nils Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 изд.). Berlin: de Gruyter. стр. 1179–1181. ISBN 978-3-11-017770-1.
- ^ а б в Takemura Kenichi; Kobayashi Kazuaki; Arai Masao (1998). „High-pressure bct-fcc phase transition in Ga”. Phys. Rev. B. 58: 2482—2486. doi:10.1103/PhysRevB.58.2482.
- ^ B. D. Sharma; J. Donohue (1962). „A refinement of the crystal structure of gallium”. Zeitschrift für Kristallographie. 117: 293—300. doi:10.1524/zkri.1962.117.16.293.
- ^ L. Bosio; A. Defrain (1969). „Structure cristalline du gallium β”. Acta Cryst. B25: 995. doi:10.1107/S0567740869003360.
- ^ L. Bosio; H. Curien; M. Dupont; A. Rimsky (1972). „Structure cristalline de Ga γ”. Acta Cryst. B28: 1974—1975. doi:10.1107/S0567740872005357.
- ^ L. Bosio; H. Curien; M. Dupont; A. Rimsky (1973). „Structure cristalline de Gaδ”. Acta Cryst. B29: 367—368. doi:10.1107/S0567740873002530.
- ^ а б Louis Bosio (1978). „Crystal structure of Ga(II) and Ga(III)”. J. Chem. Phys. 68 (3): 1221—1223. doi:10.1063/1.435841.
- ^ Manfred Merkel; Karl-Heinz Thomas (2008). Taschenbuch der Werkstoffe (7 изд.). Hanser Verlag. стр. 322—324. ISBN 978-3-446-41194-4.
- ^ G. Audi; O. Bersillon; J. Blachot; A. H. Wapstra (2003). „The NUBASE evaluation of nuclear and decay properties” (PDF). Nuclear Physics. A 729: 3—128. doi:10.1016/S0375-9474(97)00482-X. Архивирано из оригинала 24. 07. 2013. г. Приступљено 13. 01. 2021.
- ^ Mark A. Green; Michael J. Welch (1989). „Gallium radiopharmaceutical chemistry”. International Journal of Radiation Applications and Instrumentation. Part B. Nuclear Medicine and Biology. 16 (5): 435—448. doi:10.1016/0883-2897(89)90053-6.
Литература
[уреди | уреди извор]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
Спољашње везе
[уреди | уреди извор]- Gallium at The Periodic Table of Videos (University of Nottingham)
- Safety data sheet at acialloys.com
- High-resolution photographs of molten gallium, gallium crystals and gallium ingots under Creative Commons licence
- – textbook information regarding gallium
- Environmental effects of gallium
- [httpd://minerals.usgs.gov/minerals/pubs/commodity/gallium/460798.pdf Price development of gallium 1959–1998]
- Gallium: A Smart Metal United States Geological Survey
- Technology produces hydrogen by adding water to an alloy of aluminum and gallium
- Thermal conductivity
- Physical and thermodynamical properties of liquid gallium