গ্যালিয়াম
এই নিবন্ধটির রচনা সংশোধনের প্রয়োজন হতে পারে। কারণ ব্যাকরণ, রচনাশৈলী, বানান বা বর্ণনাভঙ্গিগত সমস্যা রয়েছে। (জুন ২০২৩) |
এই নিবন্ধটির তথ্যসূত্র উদ্ধৃতিদানশৈলী ঠিক নেই। (জুন ২০২৩) |
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| উচ্চারণ | /ˈɡæliəm/ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| উপস্থিতি | রূপালি-সাদা | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| আদর্শ পারমাণবিক ভরAr°(Ga) | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় সারণিতে গ্যালিয়াম | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক সংখ্যা | ৩১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| মৌলের শ্রেণী | অবস্থান্তরোত্তর ধাতু | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| গ্রুপ | গ্রুপ ১৩; (বোরন গ্রুপ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| পর্যায় | পর্যায় ৪ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ব্লক | পি-ব্লক | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইলেকট্রন বিন্যাস | [Ar] ৩d১০ ৪s২ ৪p১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| প্রতিটি কক্ষপথে ইলেকট্রন সংখ্যা | ২, ৮, ১৮, ৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভৌত বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| দশা | কঠিন | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| গলনাঙ্ক | ৩২০.৯১৪৬ কে (২৯.৭৬৪৬ °সে, ৮৫.৫৭৬৩ °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| স্ফুটনাঙ্ক | ২৪৭৭ K (২২০৪ °সে, ৩৯৯৯ °ফা) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ঘনত্ব (ক.তা.-র কাছে) | ৫.৯১ g·cm−৩ (০ °সে-এ, ১০১.৩২৫ kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তরলের ঘনত্ব | m.p.: ৬.০৯৫ g·cm−৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ফিউশনের এনথালপি | ৫.৫৯ kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| বাষ্পীভবনের এনথালপি | ২৫৪ kJ·mol−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপ ধারকত্ব | ২৫.৮৬ J·mol−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
বাষ্প চাপ
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক বৈশিষ্ট্য | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| জারণ অবস্থা | ৩, ২, ১ উভধর্মী অক্সাইড | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ-চুম্বকত্ব | ১.৮১ (পলিং স্কেল) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| আয়নীকরণ বিভব | (আরও) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| পারমাণবিক ব্যাসার্ধ | empirical: ১৩৫ pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| সমযোজী ব্যাসার্ধ | ১২২±৩ pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ভ্যান ডার ওয়ালস ব্যাসার্ধ | ১৮৭ pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| বিবিধ | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| কেলাসের গঠন | orthorhombic | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| শব্দের দ্রুতি | পাতলা রডে: ২৭৪০ m·s−১ (at 20 °সে) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় প্রসারাঙ্ক | ১.২ µm·m−১·K−১ (২৫ °সে-এ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তাপীয় পরিবাহিতা | ৪০.৬ W·m−১·K−১ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| তড়িৎ রোধকত্ব ও পরিবাহিতা | ২০ °সে-এ: ২৭০ n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| চুম্বকত্ব | ডায়াম্যাগনেটিক | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ইয়ংয়ের গুণাঙ্ক | ৯.৮ GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| পোয়াসোঁর অনুপাত | ০.৪৭ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| (মোজ) কাঠিন্য | ১.৫ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ব্রিনেল কাঠিন্য | ৬০ MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ক্যাস নিবন্ধন সংখ্যা | ৭৪৪০-৫৫-৩ | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| গ্যালিয়ামের আইসোটোপ | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||
গ্যালিয়াম হল একটি রাসায়নিক উপাদান যার প্রতীক Ga এবং পারমাণবিক সংখ্যা ৩১। ১৮৭৫ সালে ফরাসি রসায়নবিদ Paul-Emile Lecoq de Boisbaudran আবিষ্কার করেছিলেন,[৪] গ্যালিয়াম পর্যায় সারণীর 13 তম গ্রুপে রয়েছে এবং গ্রুপের অন্যান্য ধাতুর ( অ্যালুমিনিয়াম, ইন্ডিয়াম এবং থ্যালিয়াম ) অনুরূপ।
এলিমেন্টাল গ্যালিয়াম হল আদর্শ তাপমাত্রা এবং চাপে একটি নরম, রূপালী ধাতু । তরল অবস্থায় এটি রূপালী সাদা হয়ে যায়। যদি অত্যধিক বল প্রয়োগ করা হয়, তাহলে গ্যালিয়াম ভেঙে যেতে পারে(conchoidal fracture)। ১৮৭৫ সালে আবিষ্কারের পর থেকে, গ্যালিয়াম কম গলনাঙ্কের সাথে খাদ তৈরি করতে ব্যাপকভাবে ব্যবহৃত হয়েছে। এটি সেমিকন্ডাক্টরগুলিতেও ব্যবহৃত হয়, সেমিকন্ডাক্টর সাবস্ট্রেটে ডোপ্যান্ট হিসাবে।
গ্যালিয়ামের গলনাঙ্ক তাপমাত্রা রেফারেন্স পয়েন্ট হিসাবে ব্যবহৃত হয়। পারদের অ-বিষাক্ত এবং পরিবেশ বান্ধব বিকল্প হিসেবে থার্মোমিটারে গ্যালিয়াম অ্যালয় ব্যবহার করা হয় এবং পারদের চেয়ে বেশি তাপমাত্রা সহ্য করতে পারে। এমনকি খাদ হিসেবে ব্যবহৃত গ্যালিনস্তানের (ওজন অনুসারে যার ৬২–৯৫% গ্যালিয়াম, ৫–২২% ইন্ডিয়াম, এবং ০–১৬% টিন) গলনাঙ্ক দাবি করা হয় গলনাঙ্ক −১৯ °সে (−২ °ফা), যা জলের হিমাঙ্কের নীচে , তবে সুপারকুলিংয়ের প্রভাবের কারণে এটি গ্যালিনস্তানের হিমাঙ্ক হতে পারে ।
গ্যালিয়াম প্রকৃতিতে একটি মুক্ত উপাদান হিসাবে থাকে না, কিন্তু গ্যালিয়াম(III) যৌগ হিসাবে জিঙ্ক আকরিক (যেমন স্ফেলারিট ) এবং বক্সাইটে পাওয়া যায়। উপাদান হিসেবে গ্যালিয়াম ২৯.৭৬ °সে (৮৫.৫৭ °ফা) এর বেশি তাপমাত্রায় একটি তরল, এবং ৩৭.০ °সে (৯৮.৬ °ফা) এর স্বাভাবিক মানবদেহের তাপমাত্রায় একজন ব্যক্তির হাতে গলে যাবে ।
গ্যালিয়াম প্রধানত ইলেকট্রনিক্সে ব্যবহৃত হয়। গ্যালিয়াম আর্সেনাইড, ইলেকট্রনিক্সে গ্যালিয়ামের প্রাথমিক রাসায়নিক যৌগ, মাইক্রোওয়েভ সার্কিট, উচ্চ-গতির সুইচিং সার্কিট এবং ইনফ্রারেড সার্কিটে ব্যবহৃত হয়। সেমিকন্ডাক্টিং গ্যালিয়াম নাইট্রাইড এবং ইন্ডিয়াম গ্যালিয়াম নাইট্রাইড নীল এবং বেগুনি আলো-নির্গত ডায়োড এবং ডায়োড লেজার তৈরি করে। গহনার জন্য কৃত্রিম গ্যাডোলিনিয়াম গ্যালিয়াম গার্নেট উৎপাদনেও গ্যালিয়াম ব্যবহার করা হয়। ইউনাইটেড স্টেটস ন্যাশনাল লাইব্রেরি অফ মেডিসিন এবং ফ্রন্টিয়ার্স মিডিয়া দ্বারা গ্যালিয়ামকে প্রযুক্তি-সমালোচনামূলক উপাদান হিসাবে বিবেচনা করা হয়।[৫][৬]
জীববিজ্ঞানে গ্যালিয়ামের কোন পরিচিত প্রাকৃতিক ভূমিকা নেই। গ্যালিয়াম(III) জৈবিক ব্যবস্থায় ফেরিক সল্টের অনুরূপ আচরণ করে এবং ফার্মাসিউটিক্যালস এবং রেডিওফার্মাসিউটিক্যালস সহ কিছু চিকিৎসা প্রয়োগে ব্যবহৃত হয়েছে।
ভৌত ধর্ম
[সম্পাদনা]
এলিমেন্টাল গ্যালিয়াম প্রকৃতিতে পাওয়া যায় না, তবে এটি সহজেই গলানোর মাধ্যমে পাওয়া যায়। খুব খাঁটি গ্যালিয়াম হল একটি রূপালী নীল ধাতু যা কাঁচের মতো ভেঙে যায়(conchoidal fracture)। গ্যালিয়ামকে তরল হতে কঠিনে রুপান্তর করা হলে এর আয়তন ৩.১০% বৃদ্ধি পায় ; তাই, এটি কাঁচ বা ধাতব পাত্রে সংরক্ষণ করা উচিত নয় কারণ গ্যালিয়ামের অবস্থা পরিবর্তন হলে পাত্রটি ফেটে যেতে পারে। গ্যালিয়াম জল, সিলিকন, জার্মেনিয়াম, বিসমাথ এবং প্লুটোনিয়াম সহ অন্যান্য পদার্থের একটি সংক্ষিপ্ত তালিকার অন্য পদার্থের মতো উচ্চ-ঘনত্বের হিসেবে বিরাজ করে ।[৭]
গ্যালিয়াম বেশিরভাগ ধাতুর সাথে সংকর ধাতু তৈরি করে। এটি সহজেই কিছু ধাতু যেমন অ্যালুমিনিয়াম, অ্যালুমিনিয়াম – দস্তা সংকর ধাতু[৮] এবং ইস্পাত,[৯] এর ফাটলে ছড়িয়ে পড়ে, যার ফলে শক্তি এবং নমনীয়তার চরম ক্ষতি হয় যাকে liquid metal embrittlement বলা হয়।
গ্যালিয়ামের গলনাঙ্ক, ৩০২.৯১৪৬ কেলভিন (২৯.৭৬৪৬ °সে, ৮৫.৫৭৬৩ °ফা), কক্ষ তাপমাত্রার ঠিক উপরে, এবং পৃথিবীর মধ্য-অক্ষাংশে গ্রীষ্মকালীন দিনের গড় তাপমাত্রার প্রায় সমান। এই গলনাঙ্ক (mp) হল ইন্টারন্যাশনাল ব্যুরো অফ ওয়েটস অ্যান্ড মেজারস (BIPM) দ্বারা প্রতিষ্ঠিত ১৯৯০ সালের আন্তর্জাতিক তাপমাত্রা স্কেলের (ITS-90) আনুষ্ঠানিক তাপমাত্রার রেফারেন্স পয়েন্টগুলির মধ্যে একটি।[১০][১১][১২] গ্যালিয়ামের ট্রিপল পয়েন্ট, ৩০২.৯১৪৬ কেলভিন (২৯.৭৬৬৬ °সে, ৮৫.৫৭৬৩ °ফা), ইউএস ন্যাশনাল ইনস্টিটিউট অফ স্ট্যান্ডার্ডস অ্যান্ড টেকনোলজি (NIST) দ্বারা গলনাঙ্কের অগ্রাধিকারে ব্যবহার করা হয়।[১৩]
গ্যালিয়ামের গলনাঙ্কের জন্য এটি মানুষের হাতে গলে যায় এবং তারপর সরানো হলে শক্ত হয়ে যায়। তরল ধাতুর গলনাঙ্ক / হিমাঙ্কের নীচে সুপার কুল করার প্রবণতা রয়েছে : Ga ন্যানো পার্টিকেলগুলি ৯০ কেলভিনের নিচে তরল[১৪] রাখা যেতে পারে। গ্যালিয়াম হল চারটি অ-তেজস্ক্রিয় ধাতুর মধ্যে একটি ( সিজিয়াম, রুবিডিয়াম এবং পারদ সহ) যা সাধারণ ঘরের তাপমাত্রায় বা কাছাকাছি তরল হিসাবে পরিচিত। চারটির মধ্যে, গ্যালিয়ামই একমাত্র যা অত্যন্ত সক্রিয় নয় (রুবিডিয়াম এবং সিজিয়ামের মতো) বা অত্যন্ত বিষাক্ত (যেমন পারদ) এবং তাই, metal-in-glass high-temperature থার্মোমিটারে ব্যবহার করা যেতে পারে। এটি একটি ধাতুর জন্য সবচেয়ে বড় তরল পরিসরের একটি থাকার জন্য এবং উচ্চ তাপমাত্রায় কম বাষ্পের চাপ থাকার জন্য (পারদের বিপরীতে) জন্যও উল্লেখযোগ্য। গ্যালিয়ামের স্ফুটনাঙ্ক, ২৬৭৩ কেলভিন, পরম স্কেলে এর গলনাঙ্কের থেকে প্রায় নয় গুণ বেশি, যা যে কোনো উপাদানের গলনাঙ্ক এবং স্ফুটনাঙ্কের মধ্যে সবচেয়ে বড় অনুপাত।[১৫] পারদের বিপরীতে, তরল গ্যালিয়াম ধাতু কাচ এবং ত্বককে ভিজে যায়, অন্যান্য উপাদানের সাথে (কোয়ার্টজ, গ্রাফাইট, গ্যালিয়াম(III) অক্সাইড[১৬] এবং PTFE ব্যতীত),[১৭] যান্ত্রিকভাবে এটি পরিচালনা করা আরও কঠিন করে তোলে যদিও এটি যথেষ্ট কম বিষাক্ত এবং পারদের তুলনায় অনেক কম সতর্কতা প্রয়োজন। গ্লাসের উপর আঁকা গ্যালিয়াম একটি উজ্জ্বল আয়না।[১৭] এই কারণে ধাতব দূষণ এবং হিমায়িত-প্রসারণ সমস্যার পাশাপাশি, গ্যালিয়াম ধাতুর নমুনাগুলি সাধারণত অন্যান্য পাত্রের মধ্যে পলিথিন প্যাকেটে সরবরাহ করা হয়।
| সম্পত্তি | ক | খ | গ |
|---|---|---|---|
| α (~25 °C, μm/m) | 16 | 11 | 31 |
| ρ (২৯.৭ °C, nΩ·m) | 543 | 174 | 81 |
| ρ (0 °C, nΩ·m) | 480 | 154 | 71.6 |
| ρ (77 K, nΩ·m) | 101 | 30.8 | 14.3 |
| ρ (4.2 K, pΩ·m) | 13.8 | ৬.৮ | 1.6 |
গ্যালিয়াম কোনো সাধারণ কাঠামোর স্ফটিক গঠন করে না। স্বাভাবিক অবস্থায় স্থিতিশীল পর্যায়টি প্রচলিত একক কোষে ৮টি পরমাণু সহ অর্থরহম্বিক কাঠামোর স্ফটিক গঠন করে । একটি ইউনিটে , প্রতিটি পরমাণুর শুধুমাত্র একটি নিকটতম প্রতিবেশী থাকে (২৪৪ দূরত্বে বিকাল ) অবশিষ্ট ছয়টি ইউনিট সেল প্রতিবেশী ২৭, ৩০ এবং ৩৯ ব্যবধানে রয়েছে pm আরও দূরে, এবং তারা একই দূরত্বের সাথে জোড়ায় গোষ্ঠীবদ্ধ। তাপমাত্রা এবং চাপের জন্য[১৯] অনেক স্থিতিশীল এবং মেটাস্টেবল পর্যায় হিসাবে পাওয়া যায়।[২০]
দুই নিকটতম প্রতিবেশীর মধ্যে বন্ধন হল সমযোজী ; তাই Ga 2 ডাইমারকে ক্রিস্টালের মৌলিক বিল্ডিং ব্লক হিসাবে দেখা হয়। এই কারণে প্রতিবেশী উপাদান, অ্যালুমিনিয়াম এবং ইন্ডিয়ামের তুলনায় গ্যালিয়াম এর গলনাংক কম । এই গঠনটি আয়োডিনের মতোই আশ্চর্যজনকভাবে অনুরূপ এবং গ্যালিয়াম পরমাণুর একক 4p ইলেকট্রনের মধ্যে মিথস্ক্রিয়া হওয়ার কারণে তৈরি হতে পারে, 4s ইলেকট্রন এবং [Ar] 3d 10 কোরের চেয়ে নিউক্লিয়াস থেকে আরও দূরে। এই ঘটনাটি তার "সিউডো-নোবল-গ্যাস" [Xe]4f 14 5d 10 6s 2 ইলেকট্রন কনফিগারেশনের সাথে পারদের সাথে পুনরাবৃত্তি করে, যা ঘরের তাপমাত্রায় তরল।[২১] 3d 10 ইলেকট্রনগুলি নিউক্লিয়াস থেকে বাইরের ইলেকট্রনগুলিকে খুব ভালভাবে রক্ষা করে না এবং তাই গ্যালিয়ামের প্রথম আয়নিকরণ শক্তি অ্যালুমিনিয়ামের চেয়ে বেশি।[৭] Ga 2 ডাইমারগুলি তরল অবস্থায় টিকে থাকে না এবং তরল গ্যালিয়াম একটি জটিল নিম্ন-সমন্বিত কাঠামো প্রদর্শন করে যেখানে প্রতিটি গ্যালিয়াম পরমাণু ১১-১২টি প্রতিবেশীর পরিবর্তে ১০টি অন্যান্য দ্বারা বেষ্টিত থাকে।[২২][২৩]
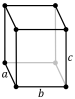
গ্যালিয়ামের ভৌত বৈশিষ্ট্যগুলি অত্যন্ত অ্যানিসোট্রপিক, অর্থাৎ তিনটি প্রধান ক্রিস্টালোগ্রাফিক অক্ষ a, b, এবং c (টেবিল দেখুন) বরাবর বিভিন্ন মান রয়েছে, যা রৈখিক (α) এবং আয়তনের তাপীয় প্রসারণ সহগগুলির মধ্যে একটি উল্লেখযোগ্য পার্থক্য তৈরি করে। গ্যালিয়ামের বৈশিষ্ট্য দৃঢ়ভাবে তাপমাত্রা-নির্ভর, বিশেষ করে গলনাঙ্কের কাছাকাছি। উদাহরণস্বরূপ, তাপ সম্প্রসারণের সহগ গলে যাওয়ার পরে কয়েকশ শতাংশ বৃদ্ধি পায়।[১৮]
আইসোটোপ
[সম্পাদনা]গ্যালিয়ামের ৩১টি পরিচিত আইসোটোপ রয়েছে, যার ভর সংখ্যা ৫৬ থেকে ৮৬ পর্যন্ত। শুধুমাত্র দুটি আইসোটোপ স্থিতিশীল এবং প্রাকৃতিকভাবে ঘটে, গ্যালিয়াম-৬৯ এবং গ্যালিয়াম-৭১। গ্যালিয়াম -৬৯ আরও প্রচুর: এটি প্রাকৃতিকভাবে প্রাপ্ত গ্যালিয়ামের প্রায় ৬০.১% , যেখানে গ্যালিয়াম -৭১ হলো বাকি ৩৯.৯% । এর অন্যান্য সমস্ত আইসোটোপ তেজস্ক্রিয়, গ্যালিয়াম-৬৭ সবচেয়ে দীর্ঘস্থায়ী (অর্ধায়ু ৩.২৬১) দিন)। গ্যালিয়াম-৬৯ এর চেয়ে হালকা আইসোটোপগুলি সাধারণত বিটা প্লাস ক্ষয় (পজিট্রন নির্গমন) বা ইলেকট্রন ক্যাপচারের মাধ্যমে জিঙ্কের আইসোটোপে ক্ষয়প্রাপ্ত হয়, যদিও হালকা কিছু (ভর সংখ্যা ৫৬-৫৯) প্রম্পট প্রোটন নির্গমনের মাধ্যমে ক্ষয় হয়। গ্যালিয়াম-৭১ এর চেয়ে ভারী আইসোটোপগুলি বিটা বিয়োগ ক্ষয় (ইলেকট্রন নিঃসরণ) এর মাধ্যমে, সম্ভবত বিলম্বিত নিউট্রন নির্গমনের সাথে, জার্মেনিয়ামের আইসোটোপে, যখন গ্যালিয়াম-৭১ বিটা বিয়োগ ক্ষয় এবং ইলেকট্রন ক্যাপচার উভয়ের মাধ্যমে ক্ষয় করতে পারে। গ্যালিয়াম-৬৭ আলোক আইসোটোপগুলির মধ্যে অনন্য একটি ক্ষয় মোড হিসাবে শুধুমাত্র ইলেক্ট্রন ক্যাপচার করে, কারণ এর ক্ষয় শক্তি পজিট্রন নির্গমনের অনুমতি দেওয়ার জন্য যথেষ্ট নয়।[২৪] গ্যালিয়াম- এ৭৬বং গ্যালিয়াম-৬৮ (অর্ধ-জীবন ৬৭.৭ min) উভয়ই পারমাণবিক ওষুধে ব্যবহৃত হয়।
রাসায়নিক ধর্ম
[সম্পাদনা]গ্যালিয়াম প্রাথমিকভাবে +3 জারণ অবস্থায় পাওয়া যায়। +1 অক্সিডেশন অবস্থা কিছু যৌগের মধ্যেও পাওয়া যায়, যদিও এটি গ্যালিয়ামের ভারী কনজেনার ইন্ডিয়াম এবং থ্যালিয়ামের তুলনায় কম সাধারণ। উদাহরণস্বরূপ, অত্যন্ত স্থিতিশীল GaCl 2-এ গ্যালিয়াম(I) এবং গ্যালিয়াম(III) উভয়ই রয়েছে এবং এটিকে Ga I Ga III Cl 4 হিসাবে প্রণয়ন করা যেতে পারে; বিপরীতে, মনোক্লোরাইড এর উপরে অস্থির ০°সে, মৌলিক গ্যালিয়াম এবং গ্যালিয়াম(III) ক্লোরাইডের মধ্যে অসামঞ্জস্যপূর্ণ । Ga–Ga বন্ধন ধারণকারী যৌগগুলি প্রকৃত গ্যালিয়াম (II) যৌগ, যেমন GaS (যাকে Ga 2 4+ (S 2− ) 2 হিসাবে প্রণয়ন করা যেতে পারে) এবং ডাইঅক্সান কমপ্লেক্স Ga 2 Cl 4 (C 4 H 8 O 2 ) 2[২৫]
জলীয় রসায়ন
[সম্পাদনা]শক্তিশালী অ্যাসিড গ্যালিয়াম দ্রবীভূত করে, গ্যালিয়াম (III) লবণ তৈরি করে যেমন Ga(NO3)3 (গ্যালিয়াম নাইট্রেট)। গ্যালিয়াম (III) লবণের জলীয় দ্রবণে হাইড্রেটেড গ্যালিয়াম আয়ন থাকে, [Ga(H
2O)
6]3+
.[২৬] :১০৩৩গ্যালিয়াম(III) হাইড্রক্সাইড, Ga(OH)
3, অ্যামোনিয়া যোগ করে গ্যালিয়াম(III) দ্রবণ থেকে অবক্ষয় হতে পারে। ১০০° সে তাপমাত্রায় Ga(OH)
3 কে ডিহাইড্রেট করা হলে গ্যালিয়াম অক্সাইড হাইড্রোক্সাইড, GaO(OH) উৎপন্ন করে।[২৭] :১৪০–১৪১
ক্ষারীয় হাইড্রক্সাইড দ্রবণ গ্যালিয়ামকে দ্রবীভূত করে, গ্যালেট লবণ তৈরি করে (অভিন্ন নামযুক্ত গ্যালিক অ্যাসিড লবণের সাথে বিভ্রান্ত হবে না) যার মধ্যে Ga(OH)−
4অ্যানায়ন ।[২৬] :১০৩৩[২৮][২৯] গ্যালিয়াম হাইড্রোক্সাইড, যা অ্যামফোটেরিক, এছাড়াও ক্ষারে দ্রবীভূত হয়ে গ্যালেট লবণ তৈরি করে।[২৭] :১৪১যদিও পূর্বের কাজ প্রস্তাবিত Ga(OH)3−
6আরেকটি সম্ভাব্য গ্যালেট অ্যানিয়ন হিসাবে,[৩০] পরবর্তী কাজে এটি পাওয়া যায়নি।[২৯]
অক্সাইড এবং চ্যালকোজেনাইড
[সম্পাদনা]গ্যালিয়াম শুধুমাত্র অপেক্ষাকৃত উচ্চ তাপমাত্রায় চ্যালকোজেনের সাথে বিক্রিয়া করে। ঘরের তাপমাত্রায়, গ্যালিয়াম ধাতু বায়ু এবং জলের সাথে বিক্রিয়াশীল হয় না কারণ এটি একটি নিষ্ক্রিয়, প্রতিরক্ষামূলক অক্সাইড স্তর গঠন করে। উচ্চ তাপমাত্রায়, তবে, এটি বায়ুমণ্ডলীয় অক্সিজেনের সাথে বিক্রিয়া করে গ্যালিয়াম(III) অক্সাইড তৈরি করে, Ga
2O
3[২৮] ৫০০° থেকে ৭০০° সে এ ভ্যাকুয়ামে মৌলিক গ্যালিয়াম সহ Ga
2O
3 কে কমানো হলে গাঢ় বাদামী গ্যালিয়াম(I) অক্সাইড, Ga
2O উৎপন্ন করে।[২৭] :২৮৫ Ga
2O একটি অত্যন্ত শক্তিশালী হ্রাসকারী এজেন্ট, H
2SO
4 কে H
2S তে কমাতে সক্ষম।[২৭] :২০৭এটি ৮০০°সে এ অসামঞ্জস্যপূর্ণ গ্যালিয়াম এবং Ga
2O
3 তে ফিরে যায় ।[৩১]
গ্যালিয়াম(III) সালফাইড, Ga
2S
3 এর ৩টি সম্ভাব্য স্ফটিক পরিবর্তন আছে.[৩১] :১০৪এটি ৯৫০° সে এ গ্যালিয়াম এর সাথে হাইড্রোজেন সালফাইড ( H
2S) এর বিক্রিয়ায় উৎপাদন করা যায় ।[২৭] :১৬২বিকল্পভাবে, ৭৪৭° সে এ Ga(OH)
3 ব্যবহার করা যাবে ।[৩২]
- 2 Ga(OH)
3 + 3 H
2S → Ga
2S
3 + 6 H
2O
ক্ষার ধাতব কার্বনেট মিশ্রণের এবং Ga
2O
3 এর সাথে H
2S এর বিক্রিয়ায়থায়োগ্যালেটস গঠিত হয় যা [Ga
2S
4]2−
অ্যানায়ন ধারণ করে। শক্তিশালী অ্যাসিড এই লবণগুলিকে পচিয়ে দেয় ও এ প্রক্রিয়ায় H
2S মুক্ত করে।[৩১] :১০৪–১০৫পারদ লবণ, HgGa
2S
4, একটি ফসফার হিসাবে ব্যবহার করা যেতে পারে।[৩৩]
গ্যালিয়াম নিম্ন জারণ অবস্থায়ও সালফাইড গঠন করে, যেমন গ্যালিয়াম (II) সালফাইড এবং সবুজ গ্যালিয়াম (I) সালফাইড, যার পরবর্তীটি 1000-এ উত্তাপের মাধ্যমে আগের থেকে উত্পাদিত হয় নাইট্রোজেনের প্রবাহের নিচে °সে.[৩১] :৯৪
অন্যান্য বাইনারি চ্যালকোজেনাইড, Ga
2Se
3 এবং Ga
2Te
3, জিঙ্কব্লেন্ড গঠন আছে. তারা সব সেমিকন্ডাক্টর কিন্তু সহজে হাইড্রোলাইজড এবং সীমিত ইউটিলিটি আছে।[৩১] :১০৪
নাইট্রাইড এবং নিকটাইড
[সম্পাদনা]গ্যালিয়াম 1050 এ অ্যামোনিয়ার সাথে বিক্রিয়া করে °C গ্যালিয়াম নাইট্রাইড, GaN গঠন করতে। গ্যালিয়াম ফসফরাস, আর্সেনিক এবং অ্যান্টিমনি সহ বাইনারি যৌগ গঠন করে: গ্যালিয়াম ফসফাইড (GaP), গ্যালিয়াম আর্সেনাইড (GaAs), এবং গ্যালিয়াম অ্যান্টিমোনাইড (GaSb)। এই যৌগগুলির গঠন ZnS এর মতোই, এবং গুরুত্বপূর্ণ অর্ধপরিবাহী বৈশিষ্ট্য রয়েছে।[২৬] :১০৩৪GaP, GaAs এবং GaSb মৌলিক ফসফরাস, আর্সেনিক বা অ্যান্টিমনির সাথে গ্যালিয়ামের সরাসরি প্রতিক্রিয়া দ্বারা সংশ্লেষিত হতে পারে।[৩১] :৯৯তারা GaN এর চেয়ে উচ্চতর বৈদ্যুতিক পরিবাহিতা প্রদর্শন করে।[৩১] :১০১ কম তাপমাত্রায় ফসফরাস সহ Ga
2O বিক্রিয়া করেও GaP সংশ্লেষিত হতে পারে।[৩৪]
গ্যালিয়াম টারনারি নাইট্রাইড গঠন করে; উদাহরণস্বরূপ:[৩১] :৯৯
- Li
3Ga + N
2 → Li
3GaN
2
ফসফরাস এবং আর্সেনিকের সাথে অনুরূপ যৌগগুলি সম্ভব: Li
3GaP
2 এবং Li
3GaAs
2 এই যৌগগুলি সহজেই পাতলা অ্যাসিড এবং জল দ্বারা হাইড্রোলাইজ করা হয়।[৩১] :১০১
হ্যালাইডসমূহ
[সম্পাদনা]গ্যালিয়াম(III) অক্সাইড ফ্লোরিনেটিং এজেন্ট যেমন HF বা F
2 এর সাথে বিক্রিয়া করে গ্যালিয়াম(III) ফ্লোরাইড, GaF
3 গঠন করতে GaF
3 এটি একটি আয়নিক যৌগ যা পানিতে দৃঢ়ভাবে অদ্রবণীয়। যাইহোক, এটি হাইড্রোফ্লুরিক অ্যাসিডে দ্রবীভূত হয়, যাতে এটি জলের সাথে একটি অ্যাডাক্ট গঠন করে, GaF
3·3H
2O । এই অ্যাডাক্টকে ডিহাইড্রেট করার চেষ্টা করা GaF
2OH·nH
2O গঠন করে। এই অ্যাডাক্টটি অ্যামোনিয়ার সাথে বিক্রিয়া করে GaF
3·3NH
3 গঠন করে, যাকে তখন উত্তপ্ত করে নির্জল GaF
3 গঠন করা যায়।[২৭] :১২৮–১২৯
ক্লোরিন গ্যাসের সাথে গ্যালিয়াম ধাতুর বিক্রিয়ায় গ্যালিয়াম ট্রাইক্লোরাইড তৈরি হয়।[২৮] ট্রাইফ্লুরাইডের বিপরীতে, গ্যালিয়াম (III) ক্লোরাইড ডাইমেরিক অণু হিসাবে বিদ্যমান, Ga
2Cl
6 ,যার গলনাঙ্ক ৭৮°সে। একই জাতীয় যৌগ ব্রোমিন এবং আয়োডিন এর সাথেও তৈরি করা যায়, Ga
2Br
6 ও Ga
2I
6 ।
অন্যান্য গ্রুপ 13 ট্রাইহালাইডের মতো, গ্যালিয়াম(III) হ্যালাইডগুলি হল লুইস অ্যাসিড, হ্যালাইড গ্রহণকারী হিসাবে ক্ষার ধাতব হ্যালাইডের সাথে বিক্রিয়া করে GaX−
4 ধারণকারী লবণ তৈরি করে GaX−
4 অ্যানায়ন, যেখানে X একটি হ্যালোজেন। তারা অ্যালকাইল হ্যালাইডের সাথে বিক্রিয়া করে কার্বোকেশন এবং GaX−
4 গঠন করে।[২৭] :১৩৬–১৩৭
উচ্চ তাপমাত্রায় উত্তপ্ত হলে, গ্যালিয়াম(III) হ্যালাইডগুলি মৌলিক গ্যালিয়ামের সাথে বিক্রিয়া করে সংশ্লিষ্ট গ্যালিয়াম(I) হ্যালাইড তৈরি করে। উদাহরণস্বরূপ, GaCl
3 Ga-এর সাথে বিক্রিয়া করে GaCl গঠন করে:
- 2 Ga + GaCl
33 GaCl (g)
নিম্ন তাপমাত্রায়, সাম্যবস্থা বাম দিকে সরে যায় এবং GaCl আবার মৌলিক গ্যালিয়াম এবং GaCl
3 এ অসামঞ্জস্যপূর্ণ হয় GaCl
3 ৯৫০°সে এ HCl-এর সাথে Ga বিক্রিয়া করেও GaCl তৈরি করা যেতে পারে; পণ্য একটি লাল কঠিন হিসাবে ঘনীভূত করা যেতে পারে.[২৬] :১০৩৬
গ্যালিয়াম (I) যৌগগুলি লুইস অ্যাসিডের সাথে অ্যাডাক্ট গঠন করে স্থিতিশীল করা যেতে পারে। উদাহরণ স্বরূপ:
- GaCl + AlCl
3 → Ga+
[AlCl
4]−
তথাকথিত "গ্যালিয়াম(II) হ্যালাইডস", GaX
2, আসলে গ্যালিয়াম(I) হ্যালাইডের সাথে সংশ্লিষ্ট গ্যালিয়াম(III) হ্যালাইডের সংযোজন, যার গঠন Ga+
[GaX
4]−
. যেমন:[২৬] :১০৩৬[২৮][৩৫]
- GaCl + GaCl
3→ Ga+
[GaCl
4]−
হাইড্রাইডসমূহ
[সম্পাদনা]অ্যালুমিনিয়ামের মতো, গ্যালিয়ামও হাইড্রাইড, GaH
3 গঠন করে । GaH
3, গ্যালেন নামে পরিচিত, যা লিথিয়াম গ্যালানেট বিক্রিয়া করে উৎপাদিত হতে পারে ( LiGaH
4 ) −৩০°সে এ গ্যালিয়াম(III) ক্লোরাইড সহ:[২৬] :১০৩১
- 3 LiGaH
4 + GaCl
3 → 3 LiCl + 4 GaH
3
দ্রাবক হিসাবে ডাইমিথাইল ইথারের উপস্থিতিতে, GaH
3 পলিমারাইজ করে (GaH
3)
n যদি কোন দ্রাবক ব্যবহার না করা হয়, ডাইমার Ga
2H
6 ( digallane ) একটি গ্যাস হিসাবে গঠিত হয়। এর গঠনটি ডাইবোরেনের মতো, দুটি হাইড্রোজেন পরমাণু দুটি গ্যালিয়াম কেন্দ্রকে সেতু করে দেয়,[২৬] :১০৩১α-
যাতে অ্যালুমিনিয়ামের সমন্বয় সংখ্যা 6।[২৬] :১০০৮
গ্যালেন −১০°সে এর উপরে অস্থির, মৌলিক গ্যালিয়াম এবং হাইড্রোজেনে পচনশীল।[৩৬]
অর্গানোগালিয়াম যৌগ
[সম্পাদনা]Organogallium যৌগগুলি অর্গানোইন্ডিয়াম যৌগগুলির অনুরূপ প্রতিক্রিয়াশীল, অর্গানোঅ্যালুমিনিয়াম যৌগের তুলনায় কম প্রতিক্রিয়াশীল, কিন্তু অর্গানোথ্যালিয়াম যৌগের তুলনায় বেশি প্রতিক্রিয়াশীল।[৩৭] অ্যালকাইলগ্যালিয়ামগুলি মনোমেরিক। লুইস অম্লতা Al > Ga > In ক্রমে হ্রাস পায় এবং ফলস্বরূপ অর্গানোঅ্যালুমিনিয়াম যৌগগুলির মতো অর্গানোগালিয়াম যৌগগুলি ব্রিজড ডাইমার গঠন করে না। অর্গানোগালিয়াম যৌগগুলিও অর্গানোঅ্যালুমিনিয়াম যৌগের তুলনায় কম বিক্রিয়াশীল। তারা স্থিতিশীল পারক্সাইড গঠন করে।[৩৮] এই অ্যালকাইলগ্যালিয়ামগুলি ঘরের তাপমাত্রায় তরল, যার গলনাঙ্ক কম থাকে এবং বেশ মোবাইল এবং দাহ্য। ট্রাইফেনিলগ্যালিয়াম দ্রবণে মনোমেরিক, কিন্তু এর স্ফটিকগুলি দুর্বল আন্তঃআণবিক Ga···C মিথস্ক্রিয়ার কারণে চেইন কাঠামো গঠন করে।[৩৭]
গ্যালিয়াম ট্রাইক্লোরাইড অর্গানোগালিয়াম যৌগ গঠনের জন্য একটি সাধারণ প্রারম্ভিক বিকারক, যেমন কার্বোগ্যালেশন বিক্রিয়ায়।[৩৯] গ্যালিয়াম ট্রাইক্লোরাইড ডাইথাইল ইথারে লিথিয়াম সাইক্লোপেন্টাডিয়ানাইডের সাথে বিক্রিয়া করে ট্রাইগোনাল প্ল্যানার গ্যালিয়াম সাইক্লোপেন্টাডিয়ানাইল কমপ্লেক্স GaCp 3 গঠন করে। গ্যালিয়াম(I) হেক্সামেথাইলবেনজিনের মতো অ্যারিন লিগ্যান্ডের সাথে কমপ্লেক্স গঠন করে। যেহেতু এই লিগ্যান্ডটি বেশ ভারী, [Ga(η 6 -C 6 Me 6 )] + এর গঠনটি অর্ধ-স্যান্ডউইচের মতো। কম ভারী লিগান্ড যেমন মেসিটিলিন একটি বাঁকানো স্যান্ডউইচ গঠনে দুটি লিগ্যান্ডকে কেন্দ্রীয় গ্যালিয়াম পরমাণুর সাথে সংযুক্ত করতে দেয়। বেনজিন আরও কম ভারী এবং ডাইমার গঠনের অনুমতি দেয়: একটি উদাহরণ হল [Ga(η 6 -C 6 H 6 ) 2 ] [GaCl 4 ]·3C 6 H 6 ।[৩৭]
ইতিহাস
[সম্পাদনা]১৮৭১ সালে, গ্যালিয়ামের অস্তিত্বের বিষয়ে প্রথম রাশিয়ান রসায়নবিদ দিমিত্রি মেন্ডেলিভ ভবিষ্যদ্বাণী করেছিলেন, যিনি তার পর্যায় সারণীতে এর অবস্থান থেকে এটিকে " ইকা-অ্যালুমিনিয়াম " নাম দিয়েছিলেন। তিনি ইকা-অ্যালুমিনিয়ামের বেশ কয়েকটি বৈশিষ্ট্যের ভবিষ্যদ্বাণী করেছিলেন যা গ্যালিয়ামের প্রকৃত বৈশিষ্ট্যগুলির সাথে ঘনিষ্ঠভাবে মিলে যায়, যেমন এর ঘনত্ব, গলনাঙ্ক, অক্সাইড চরিত্র এবং ক্লোরাইডে বন্ধন।[৪০]
| বৈশিষ্ট্য | মেন্ডেলিভের ভবিষ্যদ্বাণী | প্রকৃত মান |
|---|---|---|
| পারমাণবিক ভর | ~ ৬৮ | ৬৯.৭২৩ |
| ঘনত্ব | ৫.৯ g/cm3 | ৫.৯০৪ g/cm3 |
| গলনাংক | কম | ২৯.৭৬৭ °C |
| অক্সাইডের সংকেত | ৫.৫ g/cm3 | ৫.৮৮ g/cm3 |
| হাইড্রোক্সাইডের ধর্ম | উভধর্মী | উভধর্মী |
মেন্ডেলিভ আরও ভবিষ্যদ্বাণী করেছিলেন যে ইকা-অ্যালুমিনিয়াম স্পেকট্রোস্কোপের মাধ্যমে আবিষ্কৃত হবে, এবং ধাতব ইকা-অ্যালুমিনিয়াম ধীরে ধীরে অ্যাসিড এবং ক্ষার উভয়েই দ্রবীভূত হবে এবং বাতাসের সাথে বিক্রিয়া করবে না। তিনি আরও ভবিষ্যদ্বাণী করেছিলেন যে M 2 O 3 অ্যাসিডে দ্রবীভূত হয়ে MX 3 লবণ দেবে, যে eka-অ্যালুমিনিয়াম লবণ মৌলিক লবণ তৈরি করবে, যে eka-অ্যালুমিনিয়াম সালফেট অ্যালাম তৈরি করবে, এবং সেই নির্জল MCl 3- এর ZnCl 2- এর চেয়ে বেশি অস্থিরতা থাকা উচিত। : এই সমস্ত ভবিষ্যদ্বাণী সত্য হয়ে উঠেছে।[৪১]
১৮৭৫ সালে ফরাসি রসায়নবিদ পল এমিল লেকোক ডি বোইসবউড্রান দ্বারা স্পেকট্রোস্কোপি ব্যবহার করে গ্যালিয়াম আবিষ্কৃত হয়েছিল তার বৈশিষ্ট্যগত বর্ণালী (দুটি বেগুনি রেখা) থেকে স্ফ্যালেরাইটের একটি নমুনায়।[৪২] সেই বছরের পরে, লেকোক পটাশিয়াম হাইড্রোক্সাইড দ্রবণে হাইড্রোক্সাইডের তড়িৎ বিশ্লেষণ করে মুক্ত ধাতুটি পান।[৪৩]
তিনি তার জন্মভূমি ফ্রান্সের নামানুসারে ল্যাটিন গ্যালিয়া যার অর্থ গল থেকে উপাদানটির নামকরণ করেছিলেন "গ্যালিয়া"। পরে দাবি করা হয় যে, 19 শতকে বিজ্ঞানের মানুষের পছন্দের একটি বহুভাষিক শ্লেষে, তিনি নিজের নামে গ্যালিয়াম নামও রেখেছিলেন: "লে কোক" " মোরগ " এর জন্য ফরাসি এবং "মোরগ" এর ল্যাটিন শব্দ। হল " গ্যালাস "। ১৮৭৭ সালের একটি নিবন্ধে, লেকোক এই অনুমানকে অস্বীকার করেছেন।[৪৩]
মূলত, ডি বোইসবউড্রান গ্যালিয়ামের ঘনত্ব 4.7 g/cm 3 হিসাবে নির্ধারণ করেছিলেন, একমাত্র সম্পত্তি যা মেন্ডেলিভের ভবিষ্যদ্বাণীর সাথে মেলেনি; তখন মেন্ডেলিভ তাকে চিঠি লিখে তার ঘনত্ব পুনরায় পরিমাপ করার পরামর্শ দেন এবং ডি বোইসবউড্রান তখন 5.9 g/cm 3 এর সঠিক মান অর্জন করেন, যা মেন্ডেলিভ ঠিক ভবিষ্যদ্বাণী করেছিলেন।[৪১]
১৮৭৫ সালে এটির আবিষ্কার থেকে সেমিকন্ডাক্টরের যুগ পর্যন্ত, গ্যালিয়ামের প্রাথমিক ব্যবহার ছিল উচ্চ-তাপমাত্রার থার্মোমেট্রিক্স এবং ধাতব ধাতুর ধাতু যার অস্বাভাবিক বৈশিষ্ট্য স্থিতিশীলতা বা সহজে গলানো (কিছু যেমন ঘরের তাপমাত্রায় তরল)।
১৯৬০-এর দশকে সরাসরি ব্যান্ডগ্যাপ সেমিকন্ডাক্টর হিসাবে গ্যালিয়াম আর্সেনাইডের বিকাশ গ্যালিয়ামের প্রয়োগের সবচেয়ে গুরুত্বপূর্ণ পর্যায়ের সূচনা করে।[১৭] ১৯৬০ এর দশকের শেষের দিকে, ইলেকট্রনিক্স শিল্প হালকা নির্গমনকারী ডায়োড, ফটোভোলটাইক এবং সেমিকন্ডাক্টর তৈরির জন্য বাণিজ্যিক স্কেলে গ্যালিয়াম ব্যবহার শুরু করে, যখন ধাতু শিল্প এটি[৪৪] খাদের গলনাঙ্ক কমাতে ব্যবহার করে।[৪৫]
তথ্যসূত্র
[সম্পাদনা]- ↑ "Standard Atomic Weights: গ্যালিয়াম"। CIAAW। ১৯৮৭।
- ↑ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (২০২২-০৫-০৪)। "Standard atomic weights of the elements 2021 (IUPAC Technical Report)"। Pure and Applied Chemistry (ইংরেজি ভাষায়)। আইএসএসএন 1365-3075। ডিওআই:10.1515/pac-2019-0603।
- ↑ কনদেব, এফ.জি.; ওয়াং, এম.; হুয়াং, ডব্লিউ.জে.; নাইমি, এস.; আউডি, জি. (২০২১)। "The NUBASE2020 evaluation of nuclear properties" [পারমাণবিক বৈশিষ্ট্যের নুবেস২০২০ মূল্যায়ন] (পিডিএফ)। চাইনিজ ফিজিক্স সি (ইংরেজি ভাষায়)। ৪৫ (৩): ০৩০০০১। ডিওআই:10.1088/1674-1137/abddae।
- ↑ Scerri, Eric (২০২০)। The Periodic Table: Its Story and Its Significance। Oxford University Press। পৃষ্ঠা 149। আইএসবিএন 978-0-19-091436-3।
- ↑ Cobelo-García, A.; Filella, M. (২০১৫)। "COST action TD1407: network on technology-critical elements (NOTICE)—from environmental processes to human health threats": 15188–15194। আইএসএসএন 0944-1344। ডিওআই:10.1007/s11356-015-5221-0। পিএমআইডি 26286804। পিএমসি 4592495
।
- ↑ Romero-Freire, Ana; Santos-Echeandía, Juan (২০১৯)। "Less-Studied Technology-Critical Elements (Nb, Ta, Ga, In, Ge, Te) in the Marine Environment: Review on Their Concentrations in Water and Organisms" (English ভাষায়)। আইএসএসএন 2296-7745। ডিওআই:10.3389/fmars.2019.00532
।
- ↑ ক খ Greenwood and Earnshaw, p. 222
- ↑ Tsai, W. L; Hwu, Y. (২০০৩)। "Grain boundary imaging, gallium diffusion and the fracture behavior of Al–Zn Alloy – An in situ study": 457–463। ডিওআই:10.1016/S0168-583X(02)01533-1।
- ↑ Vigilante, G. N.; Trolano, E. (জুন ১৯৯৯)। "Liquid Metal Embrittlement of ASTM A723 Gun Steel by Indium and Gallium"। Defense Technical Information Center। সংগ্রহের তারিখ ২০০৯-০৭-০৭।
- ↑ Preston–Thomas, H. (১৯৯০)। "The International Temperature Scale of 1990 (ITS-90)" (পিডিএফ): 3–10। ডিওআই:10.1088/0026-1394/27/1/002। ২০০৭-০৬-১৮ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা।
- ↑ "ITS-90 documents at Bureau International de Poids et Mesures"।
- ↑ Magnum, B. W.; Furukawa, G. T. (আগস্ট ১৯৯০)। "Guidelines for Realizing the International Temperature Scale of 1990 (ITS-90)" (পিডিএফ)। National Institute of Standards and Technology। NIST TN 1265। ২০০৩-০৭-০৪ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা।
- ↑ Strouse, Gregory F. (১৯৯৯)। "NIST realization of the gallium triple point": 147–152। সংগ্রহের তারিখ ২০১৬-১০-৩০।
- ↑ Parravicini, G. B.; Stella, A. (২০০৬)। "Extreme undercooling (down to 90K) of liquid metal nanoparticles": 033123। ডিওআই:10.1063/1.2221395।
- ↑ Greenwood and Earnshaw, p. 224
- ↑ Chen, Ziyu; Lee, Jeong-Bong (২০১৯)। "Gallium Oxide Coated Flat Surface as Non-Wetting Surface for Actuation of Liquid Metal Droplets"। 2019 IEEE 32nd International Conference on Micro Electro Mechanical Systems (MEMS)। পৃষ্ঠা 1–4। আইএসবিএন 978-1-7281-1610-5। ডিওআই:10.1109/memsys.2019.8870886।
- ↑ ক খ গ Greenwood and Earnshaw, p. 221
- ↑ ক খ Rosebury, Fred (১৯৯২)। Handbook of Electron Tube and Vacuum Techniques। Springer। পৃষ্ঠা 26। আইএসবিএন 978-1-56396-121-2।
- ↑ Bernascino, M. (১৯৯৫)। "Ab initio calculations of structural and electronic properties of gallium solid-state phases": 9988–9998। ডিওআই:10.1103/PhysRevB.52.9988। পিএমআইডি 9980044।
- ↑ "Phase Diagrams of the Elements", David A. Young, UCRL-51902 "Prepared for the U.S. Energy Research & Development Administration under contract No. W-7405-Eng-48". (1975)
- ↑ Greenwood and Earnshaw, p. 223
- ↑ Yagafarov, O. F.; Katayama, Y. (নভেম্বর ৭, ২০১২)। "Energy dispersive x-ray diffraction and reverse Monte Carlo structural study of liquid gallium under pressure": 174103। ডিওআই:10.1103/PhysRevB.86.174103 – APS-এর মাধ্যমে।
- ↑ Drewitt, James W. E.; Turci, Francesco (এপ্রিল ৯, ২০২০)। "Structural Ordering in Liquid Gallium under Extreme Conditions": 145501। ডিওআই:10.1103/PhysRevLett.124.145501। পিএমআইডি 32338984
|pmid=এর মান পরীক্ষা করুন (সাহায্য)। - ↑ আউডি, জর্জেস; বার্সিলন, অলিভিয়ের; ব্লাকহট, জিন; ওয়াপস্ট্রা, অল্ডার্ট হেনড্রিক (২০০৩), "The NUBASE evaluation of nuclear and decay properties" [পারমাণবিক এবং ক্ষয় বৈশিষ্ট্যের নুবেস মূল্যায়ন], নিউক্লিয়ার ফিজিক্স এ (ইংরেজি ভাষায়), ৭২৯: ৩–১২৮, ডিওআই:10.1016/j.nuclphysa.2003.11.001, বিবকোড:2003NuPhA.729....3A
- ↑ Greenwood and Earnshaw, p. 240
- ↑ ক খ গ ঘ ঙ চ ছ জ Wiberg, Egon; Wiberg, Nils (২০০১)। Inorganic chemistry। Academic Press। আইএসবিএন 978-0-12-352651-9।
- ↑ ক খ গ ঘ ঙ চ ছ Downs, Anthony John (১৯৯৩)। Chemistry of aluminium, gallium, indium, and thallium। Springer। আইএসবিএন 978-0-7514-0103-5।
- ↑ ক খ গ ঘ Concise encyclopedia chemistry। Walter de Gruyter। ১৯৯৪। পৃষ্ঠা 438। আইএসবিএন 978-3-11-011451-5।
- ↑ ক খ Sipos, P. L.; Megyes, T. N. (২০০৮)। "The Structure of Gallium in Strongly Alkaline, Highly Concentrated Gallate Solutions—a Raman and 71
Ga
-NMR Spectroscopic Study": 1411–1418। ডিওআই:10.1007/s10953-008-9314-y। - ↑ Hampson, N. A. (১৯৭১)। Electrochemistry—Volume 3: Specialist periodical report। Royal Society of Chemistry। পৃষ্ঠা 71। আইএসবিএন 978-0-85186-027-5।
- ↑ ক খ গ ঘ ঙ চ ছ জ ঝ Greenwood, N. N. (১৯৬২)। Advances in inorganic chemistry and radiochemistry। Academic Press। পৃষ্ঠা 94–95। আইএসবিএন 978-0-12-023605-3।
- ↑ Madelung, Otfried (২০০৪)। Semiconductors: data handbook (3rd সংস্করণ)। Birkhäuser। পৃষ্ঠা 276–277। আইএসবিএন 978-3-540-40488-0।
- ↑ Krausbauer, L.; Nitsche, R. (১৯৬৫)। "Mercury gallium sulfide, HgGa
2S
4, a new phosphor": 113–121। ডিওআই:10.1016/0031-8914(65)90110-2। - ↑ Michelle Davidson (২০০৬)। Inorganic Chemistry। Lotus Press। পৃষ্ঠা 90। আইএসবিএন 978-81-89093-39-6।
- ↑ Arora, Amit (২০০৫)। Text Book Of Inorganic Chemistry। Discovery Publishing House। পৃষ্ঠা 389–399। আইএসবিএন 978-81-8356-013-9।
- ↑ Downs, Anthony J.; Pulham, Colin R. (১৯৯৪)। Advances in Inorganic Chemistry। Academic Press। পৃষ্ঠা 198–199। আইএসবিএন 978-0-12-023641-1।
- ↑ ক খ গ Greenwoood and Earnshaw, pp. 262–5
- ↑ Uhl, W. and Halvagar, M. R. (২০০৯)। "Reducing Ga-H and Ga-C Bonds in Close Proximity to Oxidizing Peroxo Groups: Conflicting Properties in Single Molecules": 11298–11306। ডিওআই:10.1002/chem.200900746। পিএমআইডি 19780106।
- ↑ Amemiya, Ryo (২০০৫)। "GaCl3 in Organic Synthesis": 5145–5150। ডিওআই:10.1002/ejoc.200500512।
- ↑ Ball, Philip (২০০২)। The Ingredients: A Guided Tour of the Elements। Oxford University Press। পৃষ্ঠা 105। আইএসবিএন 978-0-19-284100-1।
- ↑ ক খ Greenwood and Earnshaw, p. 217.
- ↑ Lecoq de Boisbaudran, Paul Émile (১৮৭৫)। "Caractères chimiques et spectroscopiques d'un nouveau métal, le gallium, découvert dans une blende de la mine de Pierrefitte, vallée d'Argelès (Pyrénées)": 493–495।
- ↑ ক খ Weeks, Mary Elvira (১৯৩২)। "The discovery of the elements. XIII. Some elements predicted by Mendeleeff": 1605–1619। ডিওআই:10.1021/ed009p1605।
- ↑ Petkof, Benjamin (১৯৭৮)। "Gallium" (পিডিএফ)। GPO। USGS Minerals Yearbook। ২০২১-০৬-০২ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা।
- ↑ "An Overview of Gallium"। AZoNetwork। ১৮ ডিসেম্বর ২০০১।