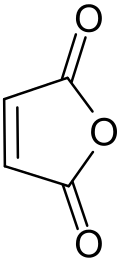
Anidrido
Anidridos são compostos resultantes da desidratação de ácidos.
Classificação
[editar | editar código-fonte]Existem duas grandes classes: Inorgânicos ou Minerais e Orgânicos. Vejamos suas diferenças.
Inorgânicos ou Minerais
[editar | editar código-fonte]Exemplo
[editar | editar código-fonte]Ácido sulfúrico água + anidrido sulfúrico
Para se obter o anidrido sulfúrico basta aquecer o ácido até seu ponto de ebulição e recolher seus vapores.
Alguns ácidos, como o ácido carbônico, se decompõem em temperatura ambiente. O gás carbônico também é conhecido como anidrido carbônico.
Orgânicos
[editar | editar código-fonte]São compostos formados por dois grupos acil ligados ao mesmo átomo de oxigênio.[1] Um caso particular são os anidridos sulfônicos, de estrutura RS(=0)2OS(=0)2R'.[2] Possuem cadeia carbônica e que podem se subdividir em:
Anidridos comuns
[editar | editar código-fonte]São aqueles em que as cadeias carbônicas são iguais nos anidridos (C=C).
Exemplo
[editar | editar código-fonte]Anidridos Mistos
[editar | editar código-fonte]São aqueles cuja cadeia carbônica tem diferente número de átomos de carbono ou seja (C C).
Exemplo
[editar | editar código-fonte]Podemos ver a seguir como se forma um anidrido orgânico:
Anidridos acíclicos (de monoácidos). Exemplo:
e Anidridos cíclicos (de diácidos).Exemplo:
Propriedades
[editar | editar código-fonte]Físicas
[editar | editar código-fonte]As moléculas dos anidridos são polares mas não fazem ligações de hidrogênio, assim sendo possuem ponto de fusão e ponto de ebulição mais baixos que os dos álcoois e dos ácidos carboxílicos correspondentes. São mais densos que a água e pouco solúveis nela, sendo no entanto mais solúveis em solventes orgânicos. Os anidridos de baixo peso molecular são líquidos de cheiro irritante e forte.
Químicas
[editar | editar código-fonte]Os anidridos acíclicos reagem com álcoois formando ésteres e o ácido correspondente e com amoníaco formando amida e sal orgânico de amônio. Veja as reações:
Tipos de Anidrido
[editar | editar código-fonte]Anidrido com álcool
[editar | editar código-fonte]Anidrido com amoníaco
[editar | editar código-fonte]Reação de Friedel-Crafts
[editar | editar código-fonte]Os compostos de anéis aromáticos (no caso, benzeno) reagem com o anidrido acético na famosa reação de Friedel-Crafts, originando cetonas, sendo que metade da molécula forma a acila e a outra metade resulta no ácido carboxílico.
Condensação de Perkin
[editar | editar código-fonte]Os aldeídos aromáticos, em presença de hidróxidos, reagem com anidridos formando ácidos insaturados .
Reações de anidridos cíclicos
[editar | editar código-fonte]Reagem com álcoois formando éster-ácido.
Exemplos
[editar | editar código-fonte]Os anidridos Succínico e o-Ftálico reagem da mesma forma, no entanto, por terem uma cadeia cíclica carbono-carbono o composto acilo e ácido carboxílico estarão na mesma molécula, contendo ao mesmo tempo estes grupos funcionais.
Anidrido Succínico
[editar | editar código-fonte]Anidrido Ftálico
[editar | editar código-fonte]Ver também
[editar | editar código-fonte]- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "acid anhydrides" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
- ↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "sulfonic anhydrides" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.