Glutatión
| Glutatión[1] | |
|---|---|
 | |
 | |
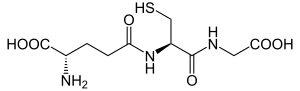
ácido (2S)-2-amino-4-{[(1R)-1-[(carboximetil)carbamoil]-2-sulfaniletil]carbamoil}butanoico | |
Outros nomes γ-L-Glutamil-L-cisteinilglicina | |
| Identificadores | |
| Abreviaturas | GSH |
| Número CAS | 70-18-8 |
| PubChem | 124886 |
| ChemSpider | 111188 |
| UNII | GAN16C9B8O |
| DrugBank | DB00143 |
| KEGG | C00051 |
| MeSH | Glutathione |
| ChEBI | CHEBI:60836 |
| ChEMBL | CHEMBL1543 |
| Código ATC | V03 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C10H17N3O6S |
| Masa molar | 307,32 g mol−1 |
| Punto de fusión | 195 °C; 383 °F; 468 K |
| Solubilidade en auga | Libremente soluble[1] |
| Solubilidade en metanol, dietil éter | Insoluble |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O glutatión,[2] abreviado como GSH (forma reducida) ou GSSG (forma oxidada disulfuro), e ás veces escrito glutation é un tripéptido formado por glicina, cisteína e ácido glutámico (γ-L-glutamil-L-cisteinilglicina), que funciona nas células como antioxidante. Contén un enlace peptídico infrecuente entre o grupo α-amino da cisteína e o grupo carboxilo da cadea lateral do ácido glutámico (e non co seu grupo α-amino, que queda libre). Polo contrario, a unión da glicina coa cisteína é un enlace peptídico totalmente normal entre os grupos α-amino e α-carboxilo. É un antioxidante, que prevén danos en compoñentes importantes da célula causados polas especies reactivas do osíxeno, como radicais libres e peróxidos.[3]
A cisteína do glutatión contén un grupo tiol (-SH) moi reactivo. Os grupos tiol son axentes redutores. Nas células animais hepáticas o glutatión está presente en concentracións de aproximadamente 5 milimolar. O glutatión reduce as pontes disulfuro formadas nas proteínas citoplásmicas a cisteínas servindo como doante de electróns. No proceso o glutatión convértese na súa forma oxidada glutatión disulfuro (GSSG).
O glutatión atópase na célula case exclusivamente na súa forma reducida, xa que o encima que reduce a súa forma oxidada, a glutatión redutase, é constitutivamente activa e inducible en situación de estrés oxidativo. De feito, a proporción do glutatión reducido con respecto ao oxidado nas células úsase a miúdo como unha medida da toxicidade na célula.[4]
Biosíntese
[editar | editar a fonte]
O glutatión non é un nutriente esencial que só se poida obter dos alimentos, xa que pode sintetizarse no noso corpo a partir dos tres aminoácidos que o compoñen. O grupo sulfhidrilo ou tiol (-SH) da súa cisteína serve como doante de protóns e é o responsable da súa actividade biolóxica. A dispoñibilidade deste aminoácido é o factor limitante na síntese do glutatión nas células, porque a cisteína é relativamente rara nos alimentos. Ademais, cando se libera como un aminoácido libre, a cisteína é tóxica e catabolízase espontaneamente no tracto gastrointestinal e no plasma sanguíneo.[6]
O glutatión sintetízase en dous pasos dependentes do ATP:
- En primeiro lugar, sintetízase a gamma-glutamilcisteína a partir de L-glutamato e cisteína por acción do encima gamma-glutamilcisteína sintetase (tamén coñecida como glutamato cisteína ligase, GCL). Esta reacción é o paso limitante na síntese do glutatión.[7]
- En segundo lugar, engádese a glicina ao extremo C-terminal do dipéptido gamma-glutamilcisteína polo encima glutatión sintetase.
A glutamato cisteína ligase (GCL) animal é un encima heterodímero composto por unha subunidade catalítica (GCLC) e outra moduladora (GCLM). A GCLC é responsable de toda a actividade encimática, mentres que a GCLM acrecenta a eficiencia catalítica do GCLC. Os ratos que carecen de GCLC (é dicir, carecen de síntese de novo de GSH) morren pouco despois do nacemento.[8] Os ratos que carecen de GCLM non mostran un fenotipo especial externamente apreciable, pero presentan un descenso acusado de GSH e un incremento da sensibilidade a tóxicos.[9][10][11]
Aínda que o glutatión pode sintetizarse en todas as células do corpo, a súa síntese no fígado é esencial. Os ratos con perda de GCLC xeneticamente inducida (é dicir, sen síntese de GSH) só no fígado morren no seu primeiro mes de vida.[12]
A glutamato cisteína ligase (GCL) das plantas é un encima heterodímero sensible aos cambios redox, moi conservado no reino das plantas.[13] Nun ambiente oxidante, fórmanse pontes disulfuro intermoleculares e o encima cambia ao seu estado dimérico activo. Ademais deste control dependente do estado redox nas plantas hai unha inhibición por retroalimentación por GSH do encima GCL.[14] A GCL está localizada exclusivamente nos plastos, e a glutatión sintetase aparece tanto en plastos coma no citosol, polo que o GSH e a gamma-glutamilcisteína son exportados desde os plastos ao citosol.[15] Ambos os encimas necesarios para a síntese do glutatión son esenciais nas plantas; a eliminación total da expresión xenética (knockout) da GCL e da glutatión sintetase son letais para o embrión e as plántulas que agroman.[16]
A ruta da biosíntese do glutatión atópase nalgunhas bacterias, como cianobacterias e proteobacterias, pero perdeuse en moitas outras bacterias. A maioría dos eucariotas sintetizan glutatión, incluíndo os humanos, pero non todos (non hai síntese en leguminosas, Entamoeba, e Giardia). As únicas arqueas que producen glutatión son as halobacterias.[17][18]
Funcións
[editar | editar a fonte]O glutatión pode atoparse en estado reducido (GSH) ou oxidado (GSSG). En estado reducido, o grupo tiol da cisteína pode doar un equivalente de redución (H++ e-) a outras moléculas inestables, como as especies reactivas do osíxeno. Ao doar un electrón, o propio glutation se fai reactivo, pero reacciona case inmediatamente con outro glutation reactivo formando glutatión disulfuro (GSSG). Esta reacción é posible debido á concentración relativamente alta de glutation nas células (ata 5 mM no fígado). O GSH pode rexenerarse a partir do GSSG por acción da glutatión redutase.
Nas células e tecidos sans, máis do 90% do total do glutatión está na forma reducida GSH e menos do 10% está en forma de disulfuro (GSSG). Un incremento da proporción de GSSG con respecto ao GSH considérase indicativa dun estrés oxidativo.
O glutatión ten múltiples funcións:
- É o principal antioxidante endóxeno producido polas células, e participa directmente na neutralización de radicais libres e compostos reactivos do osíxeno, e mantén os antioxidantes exóxenos como as vitaminas C e E no seu estado reducido activo.[19]
- Regulación do ciclo do óxido nítrico, que é esencial para a vida pero que pode ser problemático se non está regulado[20].
- Utilízase en reaccións metabólicas e biomédicas como a síntese de ADN e a súa reparación, a síntese de proteínas, síntese de prostaglandinas, transporte de aminoácidos, e a activación de encimas. Deste modo, todos os sistemas do corpo poden ser afectados polo estado do sistema do glutatión, especialmente o sistema inmunitario, o sistema nervioso, o gastrointestinal e os pulmóns.[6]
Funcións nos animais
[editar | editar a fonte]O GSH funciona como substrato tanto en reaccións de conxugación (con substancias normalmente alleas ao organismo, como drogas ou velenos) coma reaccións redox, catalizadas polos encimas glutatión S-transferases no citosol, microsomas, e mitocondrias. Pero pode participar tamén en conxugacións non encimáticas con diversas substancias.
O glutatión é un antídoto esencial para superar a sobredose de N-acetil-p-benzoquinona imina (NAPQI), un actvo metabolito reactivo co citocromo P450 formado polo paracetamol, que é tóxico cando diminúe o GSH na célula por causa de sobredose de pracetamol. O glutatión conxúgase coa NAPQI e axuda a detoxificalo. Grazas a esta capacidade protexe os grupos tiol das proteínas celulares, que doutro modo serían modificados covalentemente; cando se consome todo o GSH, a NAPQI empeza a reaccionar coas proteínas celulares, orixinando a morte celular. O tratamento habitual para unha sobredose deste analxésico é a administración (xeralmente en forma nebulizada) de N-acetil-L-cisteína (hai varios preparados comerciais [1]), que é procesada polas células a L-cisteína e utilizada na síntese de novo de GSH.
O glutatión (GSH) participa na síntese de leucotrienos e é un cofactor do encima glutatión peroxidase. Tamén é importante como molécula hidrofílica que se engade no fígado a toxinas lipófilas e residuos durante as biotransformacións antes de que esas substancias pasen a formar parte da bile. O glutatión necesítase tamén para a detoxificación do metilglioxal, unha toxina producida como un subproduto do metabolismo.
Esta reacción de detoxificación lévaa a cabo o sistema da glioxalase. A glioxalase I (EC 4.4.1.5)Arquivado 16 de maio de 2011 en Wayback Machine. cataliza a conversión do metilglioxal e do glutatión reducido a S-D-lactoíl-glutatión. A Glioxalase II (EC 3.1.2.6)Arquivado 16 de maio de 2011 en Wayback Machine. cataliza a hidrólise do S-D-lactoíl-glutatión a glutatión ed ácido D-láctico.
O glutatión utilizouse recentemente como inhibidor da melanina na industria cosmética. En países como o Xapón e Filipinas, este produto véndese como xabón blanqueante. O glutatión inhibe competitivamente a síntese de melanina na reacción entre a tirosinase e a L-DOPA ao interromper a capacidade da L-DOPA de unirse á tirosinase durante a síntese de melanina. A inhibición da síntese de melanina pode reverterse incrementando a concentración de L-DOPA, pero non incrementando a de tirosinase. Aínda que a melanina sintetizada é agregada en aproximadamente unha hora, a agregación é inhibida pola adición de glutatión. Estes resultados indican que o glutation inhibe a síntese e aglutinación da melanina ao interferir na función da L-DOPA.[21]
Funcións nas plantas
[editar | editar a fonte]Nas plantas, o glutatión é crucial para controlar o estrés biótico e abiótico. É un compoñente esencial do ciclo do glutatión-ascorbato, un sistema que reduce o velenoso peróxido de hidróxeno.[22] É o precursor das fitoquelatinas, que son oligómeros de glutatión que quelan metais pesados como o cadmio.[23] O glutatión requírese para unha defensa eficiente contra patóxenos das plantas como a bacteria Pseudomonas syringae ou o oomiceto Phytophthora brassicae.[24] O encima APS redutase, que intervén na asimilación do xofre, usa o glutatión como doante de electróns. Outros encimas que utilizan o glutatión como substrato son as glutarredoxinas; estas pequenas oxidorredutases están implicadas no desenvolvemento das flores, e a sinalización por ácido salicílico (fitohormona) para a defensa da planta.[25]
Suplementación
[editar | editar a fonte]Non é doado conseguir elevar os niveis de GSH nas células cunha suplementación de glutatión. As investigacións realizadas suxiren que o glutatión inxerido non se absorbe ben no tracto gastrointestinal. Nun estudo sobre a administración oral intensa a grandes doses (3 gramos) de glutatión oral, Witschi e colaboradores concluíron que "non é posible incrementar o glutatión circulante ata un grao clinicamente beneficioso por medio da administración oral dunha soa dose de 3 g de glutatión."[26][27]
O metabolito activo da vitamina D sintetizado nos riles calcitriol incrementa os niveis de glutatión no cerebro e parece ser un catalizador da produción de glutatión.[28]
Ademais, as concentracións plasmáticas e hepáticas de GSH poden elevarse pola administración de certos suplementos que serven como precursores do GSH. A N-acetilcisteína (NAC) é o precursor máis biodispoñible do glutatión.[29] Outros suplementos, como S-adenosilmetionina (SAMe)[30][31][32] e a proteína do soro lácteo[33][34][35][36][37][38] tamén incrementan o contido de glutatión na célula.
A N-acetilcisteína está dispoñible como fármaco ou coma un suplemento xenérico. Outra substancia que tamén restaura ou niveis intracelulares de glutatión é o ácido alfa lipoico.[39][40] A melatonina pode estimular un encima relacionado, a glutatión peroxidase,[41] e o silymarin, un extracto de sementes do cardo Silybum marianum, tamén mostrou unha capacidade de repoñer os niveis de glutatión.[42][43]
O glutatión é un compoñente intracelular estritamente regulado, e a súa produción está limitada por unha inhibición por retroalimentación da súa síntese no encima gamma-glutamilcisteína sintetase, o que minimiza enormemente a posibilidade de sobredoses. O aumento do glutatión utilizando presursores da síntese do glutatión ou glutatión intravenoso é unha estratexia empregada para facer fronte ás deficiencias de gluttión, alto estrés oxidativo, deficiencias inmunitarias, e sobrecargas de substancias xenobióticas (alleas ao corpo) nas que o glutatión xoga un papel na súa detoxificación (especialmente por vía hepática). Os estados de deficiencia de glutatión inclúen entre outros o VIH/SIDA, hepatites infecciosas e químicas, síndrome de fatiga crónica e encefalomielite miálxica (ME/CFS),[44][45][46] cáncer de próstata e outros, cataratas, enfermidade de Alzheimer, enfermidade de Parkinson, enfermidade pulmonar obstrutiva crónica, asma, envelenamento radioactivo, estados de malnutrición, estrés físico intenso, e o envellecemento, e foi asociado con respostas inmunitarias por debaixo do nivel normal. Moitas patoloxías clínicas están asociadas co estrés oxidativo e detállanse en moitas referencias médicas.[6][47][48]
Os niveis baixos de glutatión están tamén moi implicados na perda e balance negativo do nitróxeno,[49] que se observa no cáncer, SIDA, sepse, trauma, queimaduras graves e mesmo no excesivo treinamento atlético. A suplementación con glutatión pode opoñerse a estes procesos, e na SIDA, por exemplo, mellora as taxas de supervivencia.[50] Porén, os estudos de moitas desas situacións e cadros non puideron diferenciar entre os niveis baixos de glutatión resultado de niveis de estrés oxidativo incrementados de forma aguda (como nos pacientes con sepse) ou crónica (como na SIDA), e o aumento da patoloxía como resultado de deficiencias preexistentes.
A esquizofrenia e os trastornos bipolares están tamén asociados con niveis baixos de glutatión. Os datos obtidos suxiren que o estrés oxidativo pode ser un factor que subxace na fisiopatoloxía do trastorno bipolar, depresións graves, e esquizofrenia. O glutatión é o principal eliminador dos radicais libres no cerebro.[51]
Cáncer
[editar | editar a fonte]Os resultados preliminares de certos estudos indican que o glutatión cambia o nivel de especies reactivas do osíxeno en células illadas cultivadas en laboratorio,[52][53] o que pode reducir o desenvolvemento dos cánceres.[54] [55] Pero ningún destes estudos se realizou en humanos.
Porén, non está claro que sexa beneficioso cando o cáncer está xa desenvolvido, xa que podería protexer as células cancerosas das drogas da quimioterapia en diversos tipos de cáncer, como mostran diversos estudos.[56]
Patoloxía
[editar | editar a fonte]O exceso de glutamato nas sinapses, que pode ser liberado en condicións como os traumatismos cranioencefálicos, pode impedir a absorción de cisteína, un dos compoñentes do glutatión. Sen a protección contra os danos oxidativos que fornece o glutatión, as células poden quedar danadas ou morreren.[57]
Métodos para determinar o glutatión
[editar | editar a fonte]O glutatión reducido presente nunha mostra pode visualizarse utilizando o reactivo de Ellman ou derivados do bimano como monobromobimano. O método do monobromobimano é o máis sensible. Neste procedemento, as células son lisadas e extráense os tioles con HCl tampón. Os tioles son despois reducidos con ditiotreitol (DTT) e marcados con monobromobimano. O monobromobimano faise fluorescente ao unirse ao GSH. Os tioles sepáranse despois por cromatografía líquida de alta resolución e a fluorescencia cuantifícase cun detector de fluorescencia. O bimano pode tamén utilizarse para cuantificar o glutatión in vivo. A cuantificación faise por microscopía de varrido láser confocal despois da aplicación de colorantes ás células vivas.[58] Outra aproximación, que permite medir o potencial redox do glutatión a unha resulción moi alta espacial e temporal nas células vivas está baseado en imaxes redox obtidas usando a proteína fluorescente verde sensible ao estado redox (roGFP)[59] ou a proteína fluorescente amarela sensible ao estado redox (rxYFP) [60]
Notas
[editar | editar a fonte]- ↑ 1,0 1,1 Merck Index, 11th Edition, 4369
- ↑ Coordinadores: Jaime Gómez Márquez, Ana Mª Viñas Díaz e Manuel González González. Redactores: David Villar Docampo e Luís Vale Ferreira. Revisores lingüísticos: Víctor Fresco e Mª Liliana Martínez Calvo. (2010). Dicionario de bioloxía galego-castelán-inglés. (PDF). Xunta de Galicia. p. 89. ISBN 978-84-453-4973-1.
- ↑ Pompella, A; Visvikis, A; Paolicchi, A; De Tata, V; Casini, AF (2003). "The changing faces of glutathione, a cellular protagonist". Biochemical Pharmacology 66 (8): 1499–503. PMID 14555227. doi:10.1016/S0006-2952(03)00504-5.
- ↑ Pastore, Anna; Piemonte, Fiorella; Locatelli, Mattia; Russo, Anna Lo; Gaeta, Laura Maria; Tozzi, Giulia; Federici, Giorgio (2003). "Determination of blood total, reduced, and oxidized glutathione in pediatric subjects". Clinical Chemistry 47 (8): 1467–9. PMID 11468240.
- ↑ M. Orlowski, A. Meister The gamma-glutamyl cycle
- ↑ 6,0 6,1 6,2 "Copia arquivada". Arquivado dende o orixinal o 19 de agosto de 2010. Consultado o 21 de outubro de 2011.
- ↑ http://www.sciencedirect.com/science/article/pii/S000326970300143X
- ↑ Dalton, T; Dieter, MZ; Yang, Y; Shertzer, HG; Nebert, DW (2000). "Knockout of the Mouse Glutamate Cysteine Ligase Catalytic Subunit (Gclc) Gene: Embryonic Lethal When Homozygous, and Proposed Model for Moderate Glutathione Deficiency When Heterozygous". Biochemical and Biophysical Research Communications 279 (2): 324–9. PMID 11118286. doi:10.1006/bbrc.2000.3930.
- ↑ Yang, Y.; Dieter, MZ; Chen, Y; Shertzer, HG; Nebert, DW; Dalton, TP (2002). "Initial characterization of the glutamate-cysteine ligase modifier subunit Gclm(-/-) knockout mouse. Novel model system for a severely compromised oxidative stress response". Journal of Biological Chemistry 277 (51): 49446–52. PMID 12384496. doi:10.1074/jbc.M209372200.
- ↑ Giordano, G; Afsharinejad, Z; Guizzetti, M; Vitalone, A; Kavanagh, T; Costa, L (2007). "Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency". Toxicology and Applied Pharmacology 219 (2–3): 181–9. PMID 17084875. doi:10.1016/j.taap.2006.09.016.
- ↑ McConnachie, L. A.; Mohar, I.; Hudson, F. N.; Ware, C. B.; Ladiges, W. C.; Fernandez, C.; Chatterton-Kirchmeier, S.; White, C. C.; Pierce, R. H. (2007). "Glutamate Cysteine Ligase Modifier Subunit Deficiency and Gender as Determinants of Acetaminophen-Induced Hepatotoxicity in Mice". Toxicological Sciences 99 (2): 628–36. PMID 17584759. doi:10.1093/toxsci/kfm165.
- ↑ Chen, Ying; Yang, Yi; Miller, Marian L.; Shen, Dongxiao; Shertzer, Howard G.; Stringer, Keith F.; Wang, Bin; Schneider, Scott N.; Nebert, Daniel W. (2007). "Hepatocyte-specificGclcdeletion leads to rapid onset of steatosis with mitochondrial injury and liver failure". Hepatology 45 (5): 1118–28. PMID 17464988. doi:10.1002/hep.21635.
- ↑ Hothorn, M.; Wachter, A; Gromes, R; Stuwe, T; Rausch, T; Scheffzek, K (2006). "Structural Basis for the Redox Control of Plant Glutamate Cysteine Ligase". Journal of Biological Chemistry 281 (37): 27557–65. PMID 16766527. doi:10.1074/jbc.M602770200.
- ↑ Hicks, L. M.; Cahoon, R. E.; Bonner, E. R.; Rivard, R. S.; Sheffield, J.; Jez, J. M. (2007). "Thiol-Based Regulation of Redox-Active Glutamate-Cysteine Ligase from Arabidopsis thaliana". The Plant Cell Online 19 (8): 2653–61. PMC 2002632. PMID 17766407. doi:10.1105/tpc.107.052597.
- ↑ Wachter, Andreas; Wolf, Sebastian; Steininger, Heike; Bogs, Jochen; Rausch, Thomas (2004). "Differential targeting of GSH1 and GSH2 is achieved by multiple transcription initiation: implications for the compartmentation of glutathione biosynthesis in the Brassicaceae". The Plant Journal 41 (1): 15–30. PMID 15610346. doi:10.1111/j.1365-313X.2004.02269.x.
- ↑ Pasternak, Maciej; Lim, Benson; Wirtz, Markus; Hell, RüDiger; Cobbett, Christopher S.; Meyer, Andreas J. (2007). "Restricting glutathione biosynthesis to the cytosol is sufficient for normal plant development". The Plant Journal 53 (6): 999–1012. PMID 18088327. doi:10.1111/j.1365-313X.2007.03389.x.
- ↑ Copley, Shelley D; Dhillon, Jasvinder K (2002). "Lateral gene transfer and parallel evolution in the history of glutathione biosynthesis genes". Genome Biology 3 (5). doi:10.1186/gb-2002-3-5-research0025.
- ↑ Grill D, Tausz T, De Kok LJ (2001). Significance of glutathione in plant adaptation to the environment. Springer. ISBN 1402001789.
- ↑ Scholz RW. Graham KS. Gumpricht E. Reddy CC. Mechanism of interaction of vitamin E and glutathione in the protection against membrane lipid peroxidation. Ann NY Acad Sci 1989:570:514-7. Hughes RE. Reduction of dehydroascorbic acid by animal tissues.Nature 1964:203:1068-9.
- ↑ Clementi, Emilio; Brown, Guy Charles; Feelisch, Martin; Moncada, Salvador; Bugg, S; O'Connell, MJ; Goldsbrough, PB; Cobbett, CS (1999). "Phytochelatin synthase genes from Arabidopsis and the yeast Schizosaccharomyces pombe". The Plant cell 11 (6): 1153–64. JSTOR 3870806. PMC 144235. PMID 10368185. doi:10.1105/tpc.11.6.1153.
- ↑ Matsuki, Mitsuo; Watanabe, Toshihiko; Ogasawara, Ayako; Mikami, Takeshi; Matsumoto, Tatsuji (2008). "Inhibitory Mechanism of Melanin Synthesis by Glutathione". Yakugaku Zasshi 128 (8): 1203–7. PMID 18670186. doi:10.1248/yakushi.128.1203.
- ↑ Noctor, Graham; Foyer, Christine H. (1998). "ASCORBATE AND GLUTATHIONE: Keeping Active Oxygen Under Control". Annual Review of Plant Physiology and Plant Molecular Biology 49: 249–279. PMID 15012235. doi:10.1146/annurev.arplant.49.1.249.
- ↑ Ha, S.-B.; Smith, AP; Howden, R; Dietrich, WM; Bugg, S; O'Connell, MJ; Goldsbrough, PB; Cobbett, CS (1999). "Phytochelatin Synthase Genes from Arabidopsis and the Yeast Schizosaccharomyces pombe". The Plant Cell Online 11 (6): 1153–64. PMC 144235. PMID 10368185. doi:10.1105/tpc.11.6.1153.
- ↑ Parisy, Vincent; Poinssot, Benoit; Owsianowski, Lucas; Buchala, Antony; Glazebrook, Jane; Mauch, Felix (2006). "Identification of PAD2 as a γ-glutamylcysteine synthetase highlights the importance of glutathione in disease resistance of Arabidopsis". The Plant Journal 49 (1): 159–72. PMID 17144898. doi:10.1111/j.1365-313X.2006.02938.x.
- ↑ Rouhier, Nicolas; Lemaire, StéPhane D.; Jacquot, Jean-Pierre (2008). "The Role of Glutathione in Photosynthetic Organisms: Emerging Functions for Glutaredoxins and Glutathionylation". Annual Review of Plant Biology 59: 143–66. PMID 18444899. doi:10.1146/annurev.arplant.59.032607.092811.
- ↑ Witschi, A.; Reddy, S.; Stofer, B.; Lauterburg, B. H. (1992). "The systemic availability of oral glutathione". European Journal of Clinical Pharmacology 43 (6): 667–9. PMID 1362956. doi:10.1007/BF02284971.
- ↑ "AIDS Line Update". Arquivado dende o orixinal o 04 de abril de 2007. Consultado o 21 de outubro de 2011.
- ↑ Garcion, E; Wionbarbot, N; Monteromenei, C; Berger, F; Wion, D (2002). "New clues about vitamin D functions in the nervous system". Trends in Endocrinology and Metabolism 13 (3): 100–5. PMID 11893522. doi:10.1016/S1043-2760(01)00547-1.
- ↑ Gross, Clark L.; Innace, Joy K.; Hovatter, Renee C.; Meier, Henry L.; Smith, William J. (1993). "Biochemical manipulation of intracellular glutathione levels influences cytotoxicity to isolated human lymphocytes by sulfur mustard". Cell Biology and Toxicology 9 (3): 259–67. PMID 8299004. doi:10.1007/BF00755604.
- ↑ Lieber, Charles S. (2002). "S-adenosyl-L-methionine: its role in the treatment of liver disorders". The American journal of clinical nutrition 76 (5): 1183S–7S. PMID 12418503.
- ↑ Vendemiale, G.; Altomare, E.; Trizio, T.; Le Grazie, C.; Di Padova, C.; Salerno, M. T.; Carrieri, V.; Albano, O. (1989). "Effects of Oral S-Adenosyl-l-Methionine on Hepatic Glutathione in Patients with Liver Disease". Scandinavian Journal of Gastroenterology 24 (4): 407–15. PMID 2781235. doi:10.3109/00365528909093067.
- ↑ Loguercio, C; Nardi, G; Argenzio, F; Aurilio, C; Petrone, E; Grella, A; Del Vecchio Blanco, C; Coltorti, M (1994). "Effect of S-adenosyl-L-methionine administration on red blood cell cysteine and glutathione levels in alcoholic patients with and without liver disease". Alcohol and alcoholism (Oxford, Oxfordshire) 29 (5): 597–604. PMID 7811344.
- ↑ Micke, P.; Beeh, K. M.; Schlaak, J. F.; Buhl, R. (2001). "Oral supplementation with whey proteins increases plasma glutathione levels of HIV-infected patients". European Journal of Clinical Investigation 31 (2): 171–8. PMID 11168457. doi:10.1046/j.1365-2362.2001.00781.x.
- ↑ Moreno, Y. F.; Sgarbieri, VC; Da Silva, MN; Toro, AA; Vilela, MM (2006). "Features of Whey Protein Concentrate Supplementation in Children with Rapidly Progressive HIV Infection". Journal of Tropical Pediatrics 52 (1): 34–8. PMID 16014759. doi:10.1093/tropej/fmi074.
- ↑ Grey, V; Mohammed, SR; Smountas, AA; Bahlool, R; Lands, LC (2003). "Improved glutathione status in young adult patients with cystic fibrosis supplemented with whey protein". Journal of Cystic Fibrosis 2 (4): 195–8. PMID 15463873. doi:10.1016/S1569-1993(03)00097-3.
- ↑ Micke, P.; Beeh, K. M.; Buhl, R. (2002). "Effects of long-term supplementation with whey proteins on plasma glutathione levels of HIV-infected patients". European Journal of Nutrition 41 (1): 12–8. PMID 11990003. doi:10.1007/s003940200001.
- ↑ Bounous, G; Baruchel, S; Falutz, J; Gold, P (1993). "Whey proteins as a food supplement in HIV-seropositive individuals". Clinical and investigative medicine. Medecine clinique et experimentale 16 (3): 204–9. PMID 8365048.
- ↑ Bounous, G; Gold, P (1991). "The biological activity of undenatured dietary whey proteins: role of glutathione". Clinical and investigative medicine. Medecine clinique et experimentale 14 (4): 296–309. PMID 1782728.
- ↑ Shay, Kate Petersen; Moreau, Régis F.; Smith, Eric J.; Smith, Anthony R.; Hagen, Tory M. (2009). "Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential". Biochimica et Biophysica Acta (BBA) - General Subjects 1790 (10): 1149–60. PMC 2756298. PMID 19664690. doi:10.1016/j.bbagen.2009.07.026.
- ↑ Busse, E; Zimmer, G; Schopohl, B; Kornhuber, B (1992). "Influence of alpha-lipoic acid on intracellular glutathione in vitro and in vivo". Arzneimittel-Forschung 42 (6): 829–31. PMID 1418040.
- ↑ Barlowwalden, L; Reiter, R; Abe, M; Pablos, M; Menendezpelaez, A; Chen, L; Poeggeler, B (1995). "Melatonin stimulates brain glutathione peroxidase activity". Neurochemistry International 26 (5): 497–502. PMID 7492947. doi:10.1016/0197-0186(94)00154-M.
- ↑ Nencini, C; Giorgi, G; Micheli, L (2007). "Protective effect of silymarin on oxidative stress in rat brain". Phytomedicine 14 (2–3): 129–35. PMID 16638633. doi:10.1016/j.phymed.2006.02.005.
- ↑ Valenzuela, Alfonso; Aspillaga, MóNica; Vial, Soledad; Guerra, Ricardo (2007). "Selectivity of Silymarin on the Increase of the Glutathione Content in Different Tissues of the Rat". Planta Medica 55 (5): 420–2. PMID 2813578. doi:10.1055/s-2006-962056.
- ↑ Enlander, Derek (2002). "CFS Treatment using Glutathione in Immunoprop". The CFS HandBook: 58–62.
- ↑ Bounous, G; Molson, J (1999). "Competition for glutathione precursors between the immune system and the skeletal muscle: Pathogenesis of chronic fatigue syndrome". Med Hypotheses. 53(4) (oct): 347–9.
- ↑ Richards, RS; Roberts, TK (2000). "Blood parameters indicative of oxidative stress are associated with symptom expression in chronic fatigue syndrome". Redox Rep. 1 (5): 35–41.
- ↑ Glutathione: Information for Physicians: http://www.nutritionadvisor.com/glutathione.html Arquivado 28 de abril de 2007 en Wayback Machine.
- ↑ Benefits of Glutathione Enhancement in Disease or Stress: Pulmonary Disease http://www.fda.gov/ohrms/dockets/ac/00/slides/3652s1_05/tsld018.htm
- ↑ Dröge, Wulf; Holm, Eggert (1997). "Role of cysteine and glutathione in HIV infection and other diseases associated with muscle wasting and immunological dysfunction". The FASEB journal : official publication of the Federation of American Societies for Experimental Biology 11 (13): 1077–89. PMID 9367343.
- ↑ Herzenberg, L. A.; De Rosa, SC; Dubs, JG; Roederer, M; Anderson, MT; Ela, SW; Deresinski, SC; Herzenberg, LA (1997). "Glutathione deficiency is associated with impaired survival in HIV disease". Proceedings of the National Academy of Sciences 94 (5): 1967–72. PMC 20026. PMID 9050888. doi:10.1073/pnas.94.5.1967.
- ↑ Gawryluk, JW; Wang, JF; Andreazza, AC; Shao, L; Young, LT (2011). "Decreased levels of glutathione, the major brain antioxidant, in post-mortem prefrontal cortex from patients with psychiatric disorders". The international journal of neuropsychopharmacology / official scientific journal of the Collegium Internationale Neuropsychopharmacologicum (CINP) 14 (1): 123–30. PMID 20633320. doi:10.1017/S1461145710000805.
- ↑ Park (2009). "The effects of N-acetyl cysteine, buthionine sulfoximine, diethyldithiocarbamate or 3-amino-1,2,4-triazole on antimycin A-treated Calu-6 lung cells in relation to cell growth, reactive oxygen species and glutathione". Oncology Reports: 385–91. doi:10.3892/or_00000449.
- ↑ Chow, H.-H. S.; Hakim, I. A.; Vining, D. R.; Crowell, J. A.; Tome, M. E.; Ranger-Moore, J.; Cordova, C. A.; Mikhael, D. M.; Briehl, M. M. (2007). "Modulation of Human Glutathione S-Transferases by Polyphenon E Intervention". Cancer Epidemiology Biomarkers & Prevention 16 (8): 1662–6. doi:10.1158/1055-9965.EPI-06-0830.
- ↑ WebMD: Whey Protein May Prevent Prostate Cancer
- ↑ "Glutathione Information on MedicineNet.com (a WebMD feature)". Arquivado dende o orixinal o 04 de novembro de 2011. Consultado o 21 de outubro de 2011.
- ↑ Balendiran, Ganesaratnam K.; Dabur, Rajesh; Fraser, Deborah (2004). "The role of glutathione in cancer". Cell Biochemistry and Function 22 (6): 343–52. PMID 15386533. doi:10.1002/cbf.1149.
- ↑ Pereira, C; Oliveira, CR (2000). "Oxidative glutamate toxicity involves mitochondrial dysfunction and perturbation of intracellular Ca2+ homeostasis". Neuroscience Research 37 (3): 227–36. PMID 10940457. doi:10.1016/S0168-0102(00)00124-3.
- ↑ Meyer, Andreas J.; May, Mike J.; Fricker, Mark (2001). "Quantitative in vivo measurement of glutathione in Arabidopsis cells". The Plant Journal 27 (1): 67–78. PMID 11489184. doi:10.1046/j.1365-313x.2001.01071.x.
- ↑ Meyer, Andreas J.; Brach, Thorsten; Marty, Laurent; Kreye, Susanne; Rouhier, Nicolas; Jacquot, Jean-Pierre; Hell, RüDiger (2007). "Redox-sensitive GFP inArabidopsis thalianais a quantitative biosensor for the redox potential of the cellular glutathione redox buffer". The Plant Journal 52 (5): 973–86. PMID 17892447. doi:10.1111/j.1365-313X.2007.03280.x.
- ↑ Maulucci, Giuseppe; Labate, Valentina; Mele, Marina; Panieri, Emiliano; Arcovito, Giuseppe; Galeotti, Tommaso; Østergaard, H; Winther, JR; De Spirito, Marco (2008). "High-resolution imaging of redox signaling in live cells through an oxidation-sensitive yellow fluorescent protein". Science Signaling 1 (43): pl3. PMID 18957692. doi:10.1126/scisignal.143pl3.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Drevet, J (2006). "The antioxidant glutathione peroxidase family and spermatozoa: A complex story". Molecular and Cellular Endocrinology 250 (1–2): 70–9. PMID 16427183. doi:10.1016/j.mce.2005.12.027.
- Wu, Guoyao; Fang, Yun-Zhong; Yang, Sheng; Lupton, Joanne R.; Turner, Nancy D. (2004). "Glutathione metabolism and its implications for health". The Journal of nutrition 134 (3): 489–92. PMID 14988435.