Triptófano
| Triptófano | ||
|---|---|---|
 Estructura química | ||
 Modelo tridimensional | ||
| Nombre IUPAC | ||
| ácido 2-amino-3-(1H-indol-3-il) propanoico | ||
| General | ||
| Símbolo químico | Trp, W | |
| Fórmula estructural |
 | |
| Fórmula molecular | C11H12N2O2 | |
| Identificadores | ||
| Número CAS | 73-22-3[1] | |
| ChEBI | 57912 16828, 57912 | |
| ChEMBL | CHEMBL54976 | |
| ChemSpider | 6066 | |
| DrugBank | DB00150 | |
| PubChem | 6305 | |
| UNII | 8DUH1N11BX | |
| KEGG | C00078 D00020, C00078 | |
|
N[C@@H](Cc1c2ccccc2n([H])c1)C(O)=O
| ||
| Propiedades físicas | ||
| Densidad | 1340 kg/m³; 1,34 g/cm³ | |
| Masa molar | 204,23 g/mol | |
| Punto de fusión | 501 K (228 °C) | |
| Punto de descomposición | 563,65 K (291 °C) | |
| Propiedades químicas | ||
| Acidez | 2,38; 9,34 pKa | |
| Familia | Aminoácido | |
| Esencial | Sí | |
| Codón | UGG | |
| Punto isoeléctrico (pH) | 5,86 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El triptófano (abreviado como Trp o W) (también, triptofano) es un aminoácido esencial en la nutrición humana. Es uno de los 20 aminoácidos incluidos en el código genético (codón UGG). Se clasifica entre los aminoácidos apolares, también llamados hidrófobos. Se caracteriza por una cadena lateral con el grupo indol. Es esencial para promover la liberación del neurotransmisor serotonina, involucrado en la regulación del sueño y el placer. Su punto isoeléctrico se ubica a pH=5.89. La falta de triptófano puede contribuir negativamente a cuadros de ansiedad, insomnio y estrés.[cita requerida]
Fuentes de triptófano en la dieta
[editar]El triptófano es un aminoácido esencial, es decir, solo se obtiene a través de la alimentación. Abunda en los alimentos ricos en proteínas como el huevo, el amaranto, la leche, los cereales integrales, el chocolate, la avena, los dátiles, las semillas de sésamo, los garbanzos, las pipas de girasol, las pipas de calabaza, los cacahuetes, los bananos, la calabaza, la espirulina, el queso cottage, las carnes rojas, el pescado, el pollo y las almendras, entre otros. Otras legumbres como la soja, lentejas y alubias aportan una cantidad extra de triptófano y por supuesto el cacao puro.[2] Las personas que no ingieren estos alimentos tienen mayor riesgo de deficiencia de triptófano, lo mismo que quienes experimentan altos niveles de estrés. Para un buen metabolismo del triptófano, se requieren niveles adecuados de vitamina B6 y de magnesio. A diferencia de lo que se cree popularmente, la carne de pavo (véanse Meleagris y pavo doméstico) no contiene triptófano en abundancia.[3][4][5][6]
La ingesta diaria recomendada de triptófano es de 3,5 mg por día por kilogramo de peso corporal. Lo equivalente a 245 mg para una persona que pesa 70 kg. Aunque las necesidades diarias pueden ser mayores en personas con depresión.[7][8]
Propiedades
[editar]
- Como aminoácido esencial ayuda a que el organismo elabore sus propias proteínas.
- El triptófano es esencial para que la glándula pineal secrete la melatonina, que es una hormona cerebral.
- Favorece el sueño,[cita requerida] ya que la serotonina es precursora de la hormona melatonina, vital para regular el ciclo diario de sueño-vigilia.
- En algunos casos se observa un efecto antidepresivo debido a la serotonina.
- El efecto tranquilizante de la serotonina actúa como un ansiolítico.
- El triptófano es muy útil en problemas de obesidad donde el componente ansioso sea muy importante (por ejemplo en bulimias). El triptófano contribuye a que la serotonina controle el apetito evitando así la típica ansiedad por la comida, sobre todo en aquellas personas que no pueden dejar de comer todo el día.[cita requerida]
- Al actuar sobre el estrés nos puede ayudar "de rebote" a controlar los niveles de insulina, ya que esta hormona acusa, en gran manera, el estado de nuestro sistema nervioso.
- Sirve en casos de agresividad debido a tensión nerviosa por ansiedad.
- Ayuda a la formación de vitamina B3 o niacina. De hecho, con cada 60 miligramos de triptófano en la dieta, nuestro cuerpo elabora 1 mg de niacina.
- Es muy importante tomarlo media hora antes de los alimentos o fuera de las comidas ya que si no, actúa como simple aminoácido o proteína, pero no efectúa su función beneficiosa sobre el sistema nervioso.
- El triptófano no debe usarse junto con medicamentos antidepresivos o tranquilizantes sin el consentimiento de un médico especialista.
- El L-5-Hidroxitriptófano (5-HTP) es una variante más eficaz que el triptófano.
Biosíntesis
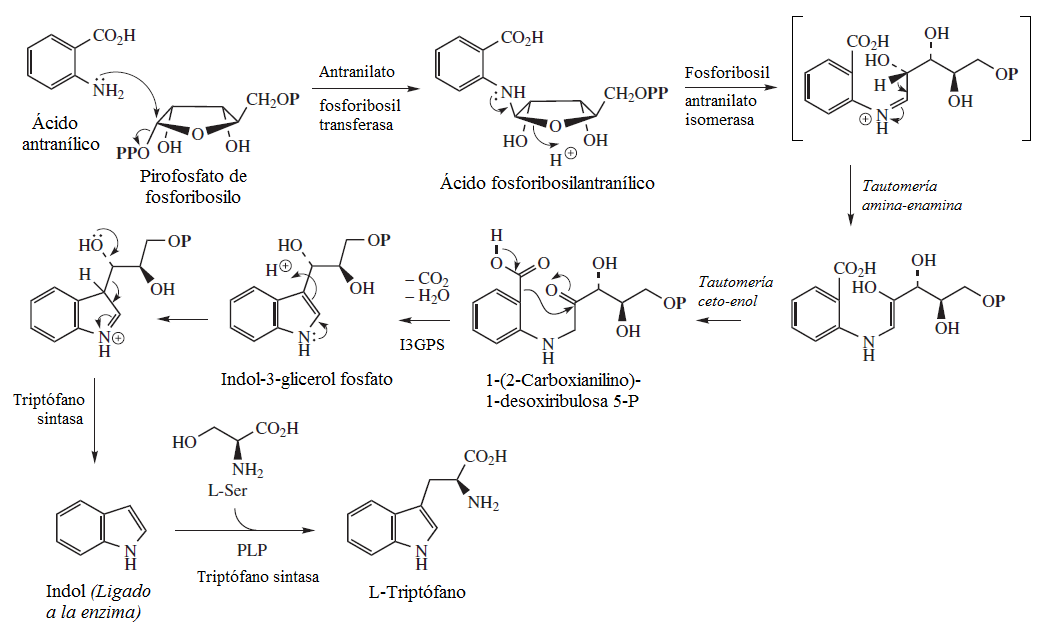
[editar]El triptófano se biosintetiza en tres etapas fundamentales: Unión entre el ácido antranílico y un éster fosfórico de ribosa con ciclización descarboxilativa, la eliminación de una molécula de gliceraldehído 3-fosfato, y la condensación con una molécula de serina. Durante la biosíntesis del triptófano, participan 4 enzimas:
- Antranilato fosforibosil transferasa: Se lleva a cabo una SN2 del grupo amino del ácido antranílico.
- Fosforibosil antralinato isomerasa: Se isomeriza la ribofuranosa a ribosa lineal.
- Indolil 3-glicerol fosfato sintasa (I3GPS): Se efectúa una descarboxilación con condesación tipo aldólica. En este paso se forma el anillo de indol con el sustituyente glicerilo en posición 3.
- Triptófano sintasa: Se lleva a cabo una eliminación por condensación aldólica inversa. Se forma un anillo de indol no sustituido y unido a la enzima. Posteriormente se realiza la condensación con serina por una reacción tipo SEA. Se forma el triptófano.[9]
Catabolismo
[editar]El catabolismo del triptófano[10] comienza con la escisción oxidativa del enlace 2,3 del anillo de indol para formar la formil quinurenina (Con catálisis de dos enzimas posibles, de acuerdo al tipo de organismo: la triptófano 2,3-dioxigenasa [EC 1.13.11.11] y la indolamina 2,3-dioxigenasa [EC 1.13.11.52]). La amida de la N-formilquinurenina se puede hidrolizar para formar quinurenina (Enzima: Quinurenina formamidasa [EC 3.5.1.9]). La quinurenina puede sufrir dos transformaciones:
- - Ruptura del carbonilo para formar alanina y ácido antranílico mediada por la quinureninasa [EC 3.7.1.3].
- - Hidroxilación en la posición 3 del anillo aromático (Enzima: quinurenina 3-monooxigenasa [EC:1.14.13.9])

Metabolismo secundario
[editar]El triptófano es un aminoácido precursor de diversos metabolitos secundarios tales como alcaloides, pigmentos y hormonas. A continuación se muestran las principales rutas del metabolismo secundario del triptófano:[11]
- Descarboxilación: Este producto de descarboxilación del triptófano es la triptamina, la cual puede seguir varios caminos:
- Alquilaciones: La triptamina puede alquilarse o hidroxilarse, formando así los alcaloides indoliletil amínicos o triptaminas. Un ejemplo clásico es la psilocibina aislada de los hongos alucinógenos Psylocibe.
- Ciclización por radicales libres: Se forman alcaloides pirroloindolicos, tales como la fisostigmina.
- Reacción de Mannich: La amina forma primero una imina con un carbonilo. La base de Schiff formada reacciona con el anillo aromático en una reacción tipo Mannich para dar una heterociclización que forma alcaloides β-carbolínicos. Los compuestos carbonílicos más comunes son el ácido pirúvico, el cual forma 1-metil β-carbolinas (como la harmina) o la secologanina (V. más adelante).
- Transaminación: Esta ruta puede formar auxinas o escatol.
- Transaminación: El producto es el ácido 3-indolilpirúvico. Este intermediario es una alternativa para formar auxinas.
- Eliminación de piruvato: A partir de la triptofanasa, el triptófano elimina piruvato para producir indol libre. Este indol se puede hidroxilar para formar indoxilo. Este intermediario puede formar el glucósido indicano, pigmentos bisindólicos (como el colorante índigo o la púrpura de Tiro) o isatinas (vía N-acetil isatina).
- 5-Hidroxilación: Se forma el intermediario 5-hidroxitriptófano. Este compuesto es precursor de aminas biológicamente activas, tales como la serotonina y la melatonina.
- Prenilación: La SEA de una unidad de pirofosfato de dimetilalilo forma el intermediario L-4-Dimetilalil triptófano. Este es el precursor de los alcaloides del ergot.
- Escisión oxidativa: Por una ruptura oxidativa del anillo heterocíclico del indol, se forma la quinurenina, un intermediario catabólico que puede formar ácido 3-hidroxiantranílico, el cual puede formar isofenoxazinas y ácido nicotínico. Otro producto posible es el ácido 5-(2'carboxietil)-4,6-dihidroxipicolínico.
El triptófano también puede formar glucosinolatos, por ejemplo, la glucobrasicina (V.Biosíntesis de glucosinolatos)

|
Existen otros compuestos que proceden del triptófano cuyas biosíntesis se revisarán en sus artículos correspondientes, tales como la camalexina, brassilexina y la estaurosporina.
Véase también
[editar]Referencias
[editar]- ↑ Número CAS
- ↑ «El Triptófano, un aminoácido esencial en periodos de ansiedad». Bioarca. Archivado desde el original el 14 de septiembre de 2021. Consultado el 14 de septiembre de 2021.
- ↑ Helmenstine AM. "Does Eating Turkey Make You Sleepy?". About.com. Consultado el 13 noviembre 2013.
- ↑ «Does Turkey Make You Sleepy?». Scientific American. 21 de noviembre de 2007. Consultado el 6 de junio de 2013.
- ↑ McCue K. "Chemistry.org: Thanksgiving, Turkey, and Tryptophan". Archived from the original on 2007-04-04. Consultado 17 agosto 2007.
- ↑ Joanne Holden, Nutrient Data Laboratory, Agricultural Research Service. «USDA National Nutrient Database for Standard Reference, Release 22». United States Department of Agriculture. Consultado el 29 de noviembre de 2009.
- ↑ «L-Tryptophan: Basic Metabolic Functions, Behavioral Research and Therapeutic Indications.». International Journal of tryptophan research.
- ↑ «Alimentos con triptófano = dormir mejor y buen humor – ¿Mito o realidad?». Nutrición360.es.
- ↑ Albert L. Lehninger, David Lee Nelson, Michael M. Cox (2005). W.H. Freeman,, ed. Principles of biochemistry, Vol. 1 4th ed. ISBN 9780716743392.
- ↑ Tryptophan metabolism - Kegg Reference pathway http://www.genome.jp/kegg/pathway/map/map00380.html Archivado el 21 de noviembre de 2020 en Wayback Machine.
- ↑ Kegg Pathway: Tryptophan metabolism http://www.genome.jp/kegg/pathway/map/map00380.html Archivado el 21 de noviembre de 2020 en Wayback Machine.
Bibliografía
[editar]- den Boer JA, Westenberg HG (1990). «Behavioral, neuroendocrine, and biochemical effects of 5-hydroxytryptophan administration in panic disorder». Psychiatry research 31 (3): 267-78. PMID 2139731. doi:10.1016/0165-1781(90)90096-N.
- Angst J, Woggon B, Schoepf J (1977). «The treatment of depression with L-5-hydroxytryptophan versus imipramine. Results of two open and one double-blind study». Archiv für Psychiatrie und Nervenkrankheiten 224 (2): 175-86. PMID 336002.
- Artículo en Psychology Today
- Turner EH, Loftis JM, Blackwell AD (2006). «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacol. Ther. 109 (3): 325-38. PMID 16023217. doi:10.1016/j.pharmthera.2005.06.004.
- chemicalsafetyfacts.org
- Información suplementaria sobre el 5-HTP del Centro Médico de la Universidad de Maryland
- E-Lactancia | Papers | MedlinePlus
