Enzim inhibitörü

Enzim inhibitörü, bir enzime bağlanan ve onun etkinliğini azaltan bir moleküldür. Bir enzimin aktivitesini engellemek, bir patojeni öldürebildiği veya bir metabolik dengesizliği düzeltebildiği için, çoğu ilaç aslında birer enzim inhibitörüdür. Ayrıca herbisit ve pestisit olarak da kullanılırlar. Enzimlere bağlanan her molekül inhibitör değildir; enzim aktivatörleri enzimlere bağlanıp onların enzim aktivitesini artırırlar.
Bir inhibitörün bağlanması bir substratın enzimin aktif bölgesine girmesine durdurabilir ve/veya enzimin kataliz yapmasını engelleyebilir. İnhibitör bağlanması tersinir veya tersinmez olabilir. Tersinir olmayan inhibitörler genelde enzim ile reaksiyona girip onu kimyasal olarak değiştirir. Bu inhibitörler enzimin aktivitesi için esas olan amino asit kalıntılarını değişime uğratırlar. Buna karşın, tersinir inhibitörler non-kovalent olarak bağlanır ve inhibitörün enzime mi, enzim-substrat kompleksine mi, yoksa ikisine birden mi bağlı olmasına bağlı olarak, farklı tip inhibisyonlar meydana gelir.
Çoğu ilaç molekülü enzim inhibitörüdür, bu yüzden onların keşfi ve geliştirilmesi biyokimya ve farmakolojide aktif bir araştırma konusudur. İlaç özelliği olan bir enzim inhibitörü çoğu zaman spesifitesi (başka proteinlere bağlanmaması) ve güçlülüğü (enzimi inhibe etmesi için gereken konsantrasyonu belirtmeye yarayan ayrışma katsayısı) ile değerlendirilir. Yüksek bir spesifisite ve güçlülük (potans), bir ilacın yan etkilerinin az ve dolasıyla toksisitesinin düşük olmasını sağlar.
Enzim inhibitörleri doğada da bulunur ve metabolizmanın düzenlenmesinde görev alır. Örneğin, bir metabolik yolaktaki enzimler, son ürünler tarafından inhibe edilebilir. Bu tip negatif geri besleme, ürünler birikmeye başlayınca yolaktaki akıyı yavaşlatır ve bu yüzden hücre içinde homeostaz sağlamanın önemli bir yoludur. Diğer hücresel enzim inhibitörleri ise bir hedef enzime spesifik olarak bağlanıp onu inhibe edebilen proteinlerdir. Bu sayede hücreye zarar verebilen enzimler, örneğin proteaz veya nükleazlar, kontrol altında tutulabilir. Bunun iyi bilinen bir örneği ribonükleaz inhibitörüdür, bu protein, bilinen en sıkı protein-protein etkileşimi ile ribonükleazlara bağlanır.[1] Doğal enzim inhibitörleri zehir de olabilirler, yırtıcılara karşı savunma olarak veya av öldürmek için kullanılırlar.
Tersinir inhibitörler
[değiştir | kaynağı değiştir]Tersinir inhibitör tipleri
[değiştir | kaynağı değiştir]Tersinir inhibitörler kovalent olmayan etkileşimlerle (hidrojen bağları, hidrofobik etkileşimler ve iyonik bağlar ile) enzimlere bağlanir. İnhibitör ile aktif bölge arasındaki birden çok zayıf bağ birleşip güçlü ve spesifik bir bağlanma meydana getirir. Substrat ve tersinmez inhibitörlerin aksine, tersinir inhibitörler genelde enzime bağlı iken kimyasal reaksiyona girmezler ve seyreltme yoluyla kolaylıkla giderilebilirler.

Dört tür tersinir enzim inhibitörü vardır. Enzim substratının konsantrasyonunu değiştirmenin inhibitör üzerindeki etkisine göre bunlar sınıflandırılır.[2]
- Yarışmalı inhibisyonda, substrat ve inhibitör enzime aynı zamanda bağlanamaz, soldaki şekilde gösterildiği gibi. Genelde bunun nedeni, substratın enzim üzerinde bağlandığı aktif bölge için inhibitörün de bir çekiciliği (afinitesi) olmasıdır. Sustrat ve inhibitör enzimin aktif bölgesi için yarışır. Substrat konsantrasyonunun yeterince yükseltilmesiyle bu tip bir inhibisyonun üstesinden gelinebilir. Yarışmalı inhibitörler genelde asıl substrata yapısal olarak benzer (aşağıda verilen örneklere bakınız).
- Yarışmasız inhibisyonda, inhibitör sadece substrat enzim kompleksine bağlanır, sınırlı yarışmalı inhibisyon ile karıştırılmamalıdır. Hem Vmax hem Km azalır (Le Chatelier prensibi ile, etkinleşmiş kompleksin azaltılması sonucu maksimum hız azalırken bağlanma verimliliği artar).
- Karışık inhibisyonda, inhibitör ve substrat aynı zamanda enzime bağlanabilir. Ancak, inhibitörün bağlanması substratın bağlanmasını, substratın bağlanması da inhibitörünkünü etkiler. Substratın konsantrasyonunu artırmakla bu tip inhibisyon azaltılabilir ama tamamen üstesinden gelinemez. Karışık tipli inhibitörlerin aktif bölgeye bağlanması mümkün olmakla beraber, bu tip inhibisyon genelde inhibitörün enzim üzerinde başka bir yere bağlanmasından kaynaklanan allosterik bir etkinin sonucudur. İnhibitörün allosterik yere bağlanması, enzimin konformasyonunu (yani üçüncül yapısı veya üç boyutlu şeklini) değiştirir, öyle ki substratın aktif bölgeye olan afinitesi azalır.
- Yarışmasız inhibisyon bir karışık inhibisyon biçimidir, inhibitörün enzime bağlanması enzim aktivitesini azaltır ama substratın bağlanmasına etki etmez. Bunun sonucunda inhibisyonun derecesi sadece inhibitör konsantrasyonuna bağlı olur.
Tersinir inhibisyonun nicel betimlemesi
[değiştir | kaynağı değiştir]Tersinir inhibisyon, inhibitörün enzime ve enzim-substrat kompleksine bağlanması ve enzimin kinetik katsayılarına etkisi ile nicel olarak betimlenebilir. Aşağıda verilen klasik Michaelis–Menten düzenine göre, bir enzim (E), substratı (S)'ye bağlanıp bir ES enzim-substrat kompleksi oluşturur. Kataliz sonucu bu kompleks ayrışır, bir ürün (P) ve serbest enzim salınır. İnhibitör (I), E veya ES'ye bağlanabilir, bunlara bağlanma katsayısı (sırasıyla) Ki veya Ki' olarak gösterilir.
Bir enzimin birden çok substratı olunca, hangi substratın değerlendirildiğine bağlı olarak inhibitörler farklı inhibisyon tipleri gösterebilirler. Bunun nedeni, aktif bölgede iki farklı bağlanma yerinin olmasıdır. Örneğin, bir inhibitör, birinci bağlanma yerinde A substratı ile yarışabilir ama ikinci bağlanma yerinde B substratı için yarışmasız bir inhibitör olabilir.[3]
Bir tersinir inhibitörün ayrışma katsayısının ölçümü
[değiştir | kaynağı değiştir]
Yukarıda belirtildiği gibi, bir enzim inhibitörü iki ayrışma katsayısı, Ki ve Ki' ile nitelenir, bunlar sırasıyla onun enzime ve enzim-substrat kompleksine bağlanması içindir. Enzim-inhibitör katsayısı Ki çeşitli yöntemlerle doğrudan ölçülebilir. Çok yüksek doğruluklu bir ölçüm yöntemi izotermal titrasyon kalorimetrisidir; inhibitör bir enzim çözeltisi içine titre edilirken salınan veya soğurulan ısı ölçülür.[4]
Buna karşın, öbür ayrışma katsayısı Ki' ölçülmesi daha zor bir değerdir, çünkü enzim-substrat kompleksi kısa ömürlüdür ve bir kimyasal reaksiyon geçirip ürünü oluşturmaktadır. Dolayısıyla Ki' genelde dolaylı olarak ölçülür, çeşitli substrat ve inhibitör konsantrasyonlarında enzim aktivitesi ölçülür ve modifiye edilmiş bir Michaelis–Menten denklemine veriler uydurulur:[5]
burada α ve α' parametreleri inhibitör konsantrasyonu ve onun iki ayrışma katsayıları ile tanımlanır:
Dolayısıyla, inhibitör varlığında, enzimin fiili Km ve Vmax değerleri α/α')Km ve (1/α')Vmax olur, sırasıyla. Ancak, bu değiştirilmiş Michaelis-Menten denklemi, inhibitörün enzime bağlanmasının dengeye ulaştığını varsayar, oysa bu, nanomolar-altı ayrışma katsayılı inhibitörler için çok yavaş bir süreç olabilir. Böylesi durumlarda, sıkı bağlanan inhibitörün tersinmez bir inhibitör olduğunu varsaymak genelde daha pratiktir. Buna rağmen, eğer Ki bağımsız olarak ölçülebilirse, Ki' değerini kinetik olarak kestirmek mümkün olabilir.
Farklı tip tersinir enzim inhibitörlerinin enzim aktivitesi üzerindeki etkileri Michaelis-Menten denkleminin grafik temsilleri (Lineweaver–Burk ve Eadie-Hofstee grafiği gibi) aracılığıyla görselleştirilebilir. Örneğin, sağdaki Lineweaver–Burk grafiğinde, yarışmalı inhibisyon doğruları y-ekseninde kesişerek bu tür inhibitörlerin Vmax üzerinde bir etkisi olmadığını gösterir. Benzer şekilde, yarışmasız inhibisyon doğruları x-ekseni üzerinde kesişir ve bu inhibitörlerin Km üzerinde bir etkisi olmadığını gösterir. Ancak, bu tür grafiklerden Ki ve Ki' değerlerini kestirmek zordur,[6] bu yüzden, yukarıda belirtildiği gibi, bu katsayıların daha güvenilir olan nonlineer regresyon yöntemleri ile kestirilmesi önerilir.
Özel durumlar
[değiştir | kaynağı değiştir]- Kısmen yarışmalı inhibisyon mekanizması, karışık yarışmalınınkine benzer. Ama, EIS kompleksinin katalitik aktivitesi vardır ve bu aktivite enzim substrat (ES) kompleksinin aktivitesinden daha düşük ve hatta (kısmen yarışmalı aktivasyon durumunda) daha yüksek olabilir. Bu inhibisyon tipik olarak daha düşük bir Vmax ama aynı kalmış bir Km değeri gösterir.[7]
- Yarışmasız inhibisyon inhibitör enzim-substrat kompleksine bağlanır ama serbest enzime bağlanmazsa meydana gelir. EIS kompleksi katalitik olarak inaktiftir. Bu biçim inhibisyon enderd görülür ve hem Vmax hem de Km değerinde azalmaya yol açar.[7]
- Substrat ve ürün inhibisyonu, ya substrat ya da ürünün enzim aktvitesini inhibe etmesi durumudur. Bu inhibisyon yarışmalı, yarışmasız veya karışık özellik gösterebilir. Substrat inhibisyonunda enzim aktivitesi artan substrat konsantrasyonlarında giderek azalır. Bu, enzim üzerinde iki substrat bağlanma yeri olduğunun belirtisi olabilir. Düşük substrat konsantrasyonunda, yüksek afiniteli bağlanma yeri dolar ve normal kinetik davranış gözlemlenir. Ancak, yüksek konsantrasyonlarda, inhibisyona neden olan ikinci bağlanma yeri substrat ile dolar ve enzim inhibe olur.[8] Ürün inhibisyonu metabolizmada sık görülen bir düzenleme (regülasyon) özelliğidir ve bir negatif geri besleme şekli olabilir.
- Yavaş-sıkı inhibisyon, ilk enzim-inhibitör kompleksi EI'nin, bir izomerizasyona uğrayıp daha sık bağlanmış bir EI* kompleksi oluşturması ile meydana gelir. İnhibisyon sürecinin tamamı tersinirdir. Bu, zamana bağlı olarak enzim inhbisyonunda bir artış şeklinde gözlemlenir. Bu şartlar altında geleneksel Michaelis-Menten kinetiği Ki için zamana bağlı olan ve sahte bir değer verir. Gerçek Ki değerini elde etmek için inhibitör bağlanmasın (kon) ve (koff) hız katsayılarının daha karmaşık bir analizi gerekir. Daha çok bilgi için aşağıda Tersinmez inhibitörler alt başlığına bakınız.
Tersinir inhibitörler için örnekler
[değiştir | kaynağı değiştir]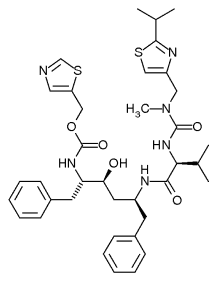
Enzimler substratlarına sıkıca bağlanmak için evrimleşmiştir ve çoğu tersinir inhibitör enzimin aktif bölgesine bağlandığı için, bu inhibitörlerin yapısal olarak hedeflerinin substratına benzer bir yapı göstermesi şaşırtıcı değildir. Bu substrat taklitçilerinin bir örneği, HIV tedavisinde etkili bir antiretroviral ilaç grubu olan proteaz inhibitörleridir.[9] Yapısı bir peptide dayalı olan ve üç peptit bağına sahip olan Ritonavir'in yapısı sağda gösterilmiştir. Bu ilaç HIV proteazının substratı olan proteine benzediği için, enzimin aktif bölgesine bağlanmak için bu substrat ile yarışır.
Enzim inhibitörleri çoğu zaman bir enzim tarafından katalizlenen reaksiyonun geçiş hâlini veya ara ürününü taklit edecek şekilde tasarlanır. Böylece geçiş hâlini stabilize edici enzim özelliği değerlendirilir ve substrata dayalı tasarımlara kıyasla daha iyi bir bağlanma afinitesi (daha düşük bir Ki) elde edilir. Bu tür bir geçiş hâli inhibitörüne örnek, antiviral bir ilaç olan oseltamivir'dir. Bu ilaç, viral nöraminidaz enziminin reaksiyonundaki halkasal oksonyum iyonunun düzlemsel özelliğini taklit eder.[10]

Ancak, tüm inhbitörler substrat yapısına dayalı değildir. Örneğin, bir diğer HIV proteaz inhibitörü olan tipranavir'in yapısı sağda gösterilmiştir. Bu molekül bir peptidin yapısına dayalı değildir ve bir protein substratı ile bariz bir yapısal benzerliği yoktur. Bu peptit olmayan inhibitörler, peptit bağı içeren inhibitörlerden daha kararlı olabilir, çünkü peptidazlar için substrat değildir ve yıkıma uğrama olasılığı daha düşüktür.[11]
İlaç tasarımında hedef enzimin gördüğü substrat konsantrasyonunu göz önüne almak önemlidir. Örneğin, bazı protein kinaz inhibitörlerinin kimyasal yapısı, bu enzimin substratlarından biri olan adenozin trifosfatınkine benzer. Ancak, basit yarışmalı inhibitör olan ilaçların hücredeki yüksek ATP konsantrasyonu ile yarışması gerekir. Protein kinazlar, kinazın substrat proteini ile etkileştiği bağlanma yeri için yarışarak da inhibe olabilir ve çoğu proteinin hücre içindeki konsantrasyonu ATP konsantrasyonundan çok daha düşüktür. Dolayısıyla, eğer iki protein kinaz inhibitörü aktif bölgeye benzer afinite ile bağlanırsa, ama biri ATP ile yarışmak zorunda ise, proteine bağlanan yerdeki yarışmalı inhibitör, enzimi daha etkili şekilde inhibe edecektir.[12]
Tersinmez inhibitörler
[değiştir | kaynağı değiştir]Tersinmez inhibisyon tipleri
[değiştir | kaynağı değiştir]
Tersinmez inhibitörler genelde bir enzimi kovalent olarak değişime uğratır (modifiye eder) ve dolayısıyla inhibisyon geriye döndürülemez. Tersinmez inhibitörler çoğu zaman reaktif fonksiyonel gruplar taşırlar, örneğin nitrojen mustard, aldehitler, haloalkanlar, alkenler, Michaelis akseptörü, fenil sülfonat, fluorofosfonatlar. Bu elektrofilik gruplar amino asit yan zincirleri ile tepkiyip kovalent katımlar (adduct) oluştururlar. Değişime uğrayan amino asit kalıntıları, yan zincirleri hidroksil veya sulfhidril grubu gibi nükleofiller içerenlerdir. Bu amino asitler arasında serin (DFP ile reaksiyona girer), sistein, treonin veya tirozin sayılabilir.[13]
Tersinmez inhibisyon, tersinmez enzim inaktivasyonundan farklıdır. Tersinmez inhibitörler genelde belli bir enzim sınıfına özgüldür (spesifiktir) ve tüm proteinleri inaktive etmezler; protein yapısını bozarak değil, hedeflerinin aktif bölgesini spesifik olarak değişime uğratarak çalışırlar. Örneğin aşırı pH veya sıcaklıklar genelde tüm protein yapısının denatürasyonuna neden olur ama bu spesifik olmayan bir etkidir. Benzer şekilde, bazı non-spesifik (spesifik olmayan) kimyasal işlemler protein yapısını imha eder: örneğin derişik hidroklorik asit peptit bağları hidroliz edip proteini parçalar.[14]
Tersinmez inhibitörler zamana bağlı inhibisyon gösterir ve dolayısıyla %50 inhibisyon sağlayan bir konsantrasyon ile nitelenemezler. Belli bir konsantrasyonda tersinmez inhibitör ile bulunan aktif enzim miktarı, inhibitörün enzim ile ne kadar süre bekletildiğine (inkübe edildiğine) bağlı olacaktır. Onun yerine, kobs/[I] değerleri kullanılır,[15] burada kobs, gözlemlenen psödo-birinci derece inaktivasyon hızıdır, aktivite yüzdesinin logaritmasını zamana göre grafikleyerek elde edilir) ve [I], inhibitörün konsantrasyonudur. kobs/[I] parametresi, inhibitörün enzime bağlanması doyuma ulaşmadıkça geçerlidir (doyuma ulaşması hâlinde kobs = kinact) .
Tersinmez inhibisyonun analizi
[değiştir | kaynağı değiştir]
Soldaki şekilde gösterildiği gibi, tersinmez inhibitörler enzim (EI veya ESI) ile önce tersinir, kovalent olmayan bir kompleks oluşturur, sonra bu reaksiyona girip kovalent değişime uğramış tersinmez kompleks EI*'yi oluşturur. EI*'nin oluşma hızına inaktivasyon hızı denir ve bu hız, kinact katsayısı ile belirtilir. EI'nin oluşumu ES ile yarışabileceği için, tersinmez inhibitörlerin bağlanması bir substrat ile veya ikinci, tersinir bir inhibitör ile engellenebilir. Bu koruyucu etki, tersinmez inhibitörün aktif bölge ile spesifik reaksiyonuna iyi bir kanıt sayılır.
Bu reaksiyonun bağlanma ve inaktivasyon adımlarının tahkiki için enzim, inhibitörle birlikte bekletilir (inkübe edilir) ve kalan aktivitesi zaman içinde ölçülür. Aktivite zamana bağlı şekilde azalır, genelde üssel azalma göstererek. Bu ölçüm değerleri bir hız denklemine uydurularak inhibitörün bu konsantrayonu için inaktivasyon hızı bulunur. Bu işlem inhibitörün birkaç farklı konsantrasyonu için yapılır. Eğer tersinir bir EI kompleksi varsa, inaktivasyon hızı doymalı olacaktır ve bu eğriye uydurarak kinact ve Ki elde edilir.[16]
Bu analizlerde yaygın olarak kullanılan bir diğer yöntem kütle spektrometresidir. Burada, değişime uğrmamamış enzimin ve inaktive olmuş eznimin kütlelerinin hassas ölçümü, inhibitör ile reaksiyon sonucu meydana gelen kütle artışını verir ve reaksiyonun stokyometresini verir.[17] Bu ölçüm genelde bir MALDI-TOF kütle spektrometresi ile yapılır. Tamamlayıcı bir teknik olan, peptit kütle parmakizlemesinde, asıl ve değişime uğramış protein, tripsin gibi bir proteaz ile sindirilir. Sindirim sonucu, kütle spektrometresi ile analiz edilebilecek bir peptitler kümesi elde edilir. İnhibitör ile reaksiyon sonucu kütlesi değişen peptit, modifikasyon yerini içerir.
Özel durumlar
[değiştir | kaynağı değiştir]
Tüm tersinmez inhibitörler hedef enzimleri ile kovalent katım ürünleri oluşturmazlar. Bazı tersinir inhibitörler hedef enzimlerine o kadar sıkı bağlanırlar ki tersinmez inhibitör gibidirler. Bu sıkı bağlanan inhibitörler, kovalent tersinmez inhibitörlere benzer kinetik özelliklere sahip olabilir. Bu durumlarda, bu inhibitörlerin bazıları enzime düşük afiniteli bir EI kompleksi oluşturacak şekilde bağlanır, bu kompleks sonra yavaş bir değişime uğrayıp sıkı bağlanmalı bir EI* kompleksi oluşturabilir (yukarıdaki şekle bakınız). Bu kinetik davranışa yavaş bağlanma denir.[19] Bağlanmayı takiben enzimin bu şekilde yeniden yapılanması çoğu zaman bir konformasyon değişimi içerir, çoğu durumda enzim inhibitör molekülün etrafına sarılır. Yavaş bağlanan inhibitör örneklerinden metotraksat,[20] allopurinol,[21] ve asiklovir (acyclovir)'in aktive olmuş hâli[22] sayılabilir.
Tersinmez inhibitörlere örnekler
[değiştir | kaynağı değiştir]
Diizopropilfluorofosfat (DFP) yukarıda sağdaki resimde tersinmez bir proteaz inhibitörü örneği olarak gösterilmiştir. Enzim fosfor-flor bağını hidrolizler ama kalan fosfat, aktif bölgedeki serine bağlı kalır ve enzimi inaktive eder.[23] Benzer şekilde, DFP nöronların sinapslarındaki asetilkolin esteraz enziminin aktif bölgesi ile reaksiyona girer ve dolayısıyla güçlü bir nörotoksindir, öldürücü dozu 100 mg'ın altındadır.[24]
İntihar inhibisyonu, olağan dışı bir inhibisyon türüdür, enzim aktif bölgesinde inhibitörü onun aktif biçimine dönüştürür. Bir örnek, poliamin biozentezinin inhibitörü α-difluorometilornitin veya DFMO, ornitin amino asidinin bir analogudur ve uyku hastalığının tedavisi için kullanılır. Ornitin dekarboksilaz DFMO'nun dekarboksilasyonunu katalizleyebilir, yukarıda gösterildiği gibi. Ancak, bu dekarboksilasyon reaksiyonunu, flor atomunun eliminasyonu izler, bu flor, katalitik ara ürünü son derece elektrofilik olan bir konjüge imin'e dönüştürür. DFMO'nun bu reaktif biçimi sonra aktif bölgedeki bir sistein veya lizin kalıntısı ile tepkiyip enzimi tersinmez olarak inaktive eder.[18]
Tersinmez inhibisyon genelde kovalent olmayan bir EI kompleksinin oluşumunu greektirdiği için, bazen bir inhibitör bir enzime birden çok şekilde bağlanabilir. Örneğin, yukarıda tripanotiyon redüktaz enzimini gösteren resimde, kuinakrin mustard adı verilen bir inhibitörün iki molekülü enzimin aktif bölgesine bağlıdır. Üstteki molekül tersinir bağlanmıştır ama alttaki kovalent bağlıdır çünkü nitrojen mustard grubu ile bir amino asit kalıntısı ile reaksiyona girmiştir.[25]
Enzim inhibitörlerinin keşfi ve tasarımı
[değiştir | kaynağı değiştir]
Yeni ilaçlar, uzun bir ilaç geliştirme sürecinin ürünüdür, bu sürecin ilk adımı çoğu zaman bir enzim inhibitörünün keşfidir. Geçmişte bu yeni inhibitörlerin keşfinin tek yolu deneme ve yanılmaydı: onbinlerce kimyasal bileşikten oluşan koleksiyonlar taranarak hedef enzime etki eden faydalı bir adayın ortaya çıkması umidedilirdi. Bu kaba kuvvete dayalı yaklaşım hâlâ başarılıdır ve kombinatoryal kimya yaklaşımı ile genişletilirek kısa sürede çok sayıda yeni bileşikler üretimini sağlar. Muazzam kimyasal "koleksiyonlar" içinden, yüksek hacimli tarama teknolojileri kullanılarak kısa sürede faydalı inhibitörler tespit edilebilir.[26]
Daha yakın zamanda alternatif bir yaklaşım yaygınlaşmıştır: rasyonel ilaç tasarımında, bir enzimin aktif bölgesinin üç boyutlu yapısını kullanarak hangi moleküllerin inhibitör olabileceğini öngörülür.[27] Bu öngörüler sonra deneysel olarak sınanır ve test edilen bileşiklerden birinin yeni bir inhibitör olduğu bulunabilir. Bunun ardından, bu molekülün aktif bölgeye nasıl bağlandığını görebilmek için bu yeni inhibitörün enzime bağlanarak oluşturduğu kompleksin yapısı çözülmeye çalışılır. Bu sayede inhibitörün moleküler yapısında değişiklikler yapılarak enzime bağlanması optimize edilebilir. Bu deneme ve iyileştirme döngüsü yeterince güçlü bir inhibitör bulunana kadar tekrar edilir.[28] Bir inhibitörün bir enzime olan afinitesinin Bilgisayara dayalı yöntemler ile öngürüsü, örneğin moleküler yanaştırma (docking)[29] ve moleküler mekanik, hâlen üzerinde yoğun çalışılan araştırma konularından biridir.
İnhibitörlerin kullanımları
[değiştir | kaynağı değiştir]Enzim inhbitörleri doğada bulunur, ayrıca farmakoloji ve biyokimya araştırmalarının bir sonucu olarak tasarlanır ve üretilir. Doğal zehirler genelde bir bitki veya hayvanın doğal düşmanlarına karşı kendini korumasını sağlayacak şekilde evrimleşmiştir. Bu doğal toksinler arasında, bilinen en zehirli bileşikler bulunur. Yapay inhibitörler genelde ilaç olarak kullanılır, ama insektisit (malatyon gibi), herbisit (gliyofosat gibi) veya dezenfektan (triklosan gibi) de olabilirler.
Kemoterapi
[değiştir | kaynağı değiştir]
 |
 |
 |
Enzim inhibitörlerinin en yaygın kullanımı, hastalık tedavisi için ilaç olaraktır. Bu inhibitörlerin çoğunda bir insan enzimini hedeflenir ve patolojik bir durumun düzeltilmesi amaçlanır. Ancak, her ilaç bir enzim inhibitörü değildir. Bazıları, örneğin anti-epileptik ilaçlar, enzimden daha çok veya daha az üretilmesini sağlayarak enzim aktivitesine etki ederler. Bu tür etkilere enzim indüksiyonu ve inhibisyonu denir, burada söz konusu olan enzim inhbisyonundan farklı olarak, bunlar gen ifadesini değiştirir. Diğer ilaçlar enzim olmayan hücresel hedeflerle, örneğin iyon kanalları ve membran reseptörlerle, etkileşir.
Tıbbi amaçlı bir enzim inhibitörü örneği sildenafil (Viagra)'dır, bu erkek ereksiyon bozukluğu için yaygın bir ilaçtır. Bu bileşik cGMP spesifik fosfodiesteraz tip 5 için güçlü bir inhibitördür, bu enzim sinyal molekülü siklik guanozin monofosfatın yıkımını yapar.[30] Bu sinyalleme molekülü düz kas gevşemesini tetikleyip ve penisteki corpus cavernosum içine kan akmasını sağlar, bu da ereksiyona neden olur. Bu ilaç, sinyali durduran enzimin aktivitesini azalttığı için, sinyalin daha uzun süre dayanmasını sağlar.
Bazı inhibitörlerin hedefledikleri enzimin substratlarına benzerliğine bir diğer örnek, metotraksat ile folik asidi karşılaştıran resimde görülebilir. Folik asit, nükleotit sentezleyen dihidrofolat redüktaz'ın bir substratıdır, bu enzim metotraksat tarafından güçlü şekilde inhibe olur. Metotraksat dihidrofolat redüktaz'ın etkisini bloke eder ve bunun sonucu nükleotit üretimini durdurur. Nükleotit biyosentezi çoğalan hücreler için daha toksiktir, çoğalmayan hücrelere kıyasla, çünkü hızla büyüyen hücreler DNA ikileşmesi yapmak zorundadır. Bu yüzden metotraksat çoğu zaman kemoterapi için kullanılır.[31]
İlaçlar patojenlerin canlı kalmaları için gerekli enzimleri inhibe etmek için de kullanılır. Örneğin, bakteriler kalın bir hücre duvarı ile çevrilidir, bu duvar, peptidoglikan adlı ağ-yapılı bir polimerden meydana gelir. Penisilin ve vankomisin gibi çoğu antibiyotik, bu polimeri oluşturan ve onun ipliklerini birbirine çapraz bağlayan enzimleri inhibe eder.[32] Bunun sonucu, hücre duvarı zayıflar ve bakteri parçalanır. Sağdaki şekilde, bir penisilin molekülü, hedefi olan Streptomyces R61 bakterisinin transpeptidaz enzimine bağlanmış olarak görülebilir.
Eğer bir patojenin canlı kalması için gerekli olan bir enzim insanda yoksa veya çok farklı ise, ilaç tasarımı kolaylaşır. Yukarıdaki örnekte, insanlar peptidoglikan yapmaz, dolayısıyla bu sürecin inhibitörleri seçici olarak bakteriler için toksiktir. Başka ilaçlarda, bakteri ribozom yapısındaki farklılıklar veya bakterilerin yağ asidi üretimindeki farklılıklar değerlendirilerek seçici toksisite elde edilmiştir.
Metabolik kontrol
[değiştir | kaynağı değiştir]Enzim inhibitörleri metabolik kontrolde de önemlidirler. Hücredeki çoğu metabolik yolak, enzim aktivitesini kontrol eden metabolitler tarafından, allosterik düzenleme (regülasyon) veya substrat inhibisyonu yoluyla, inhibe olurlar. Bunun iyi bir örneği, glikolitik yolağın allosterik düzenlemesidir. Bu katabolik yolak glükoz tüketir ve ATP, NADH ve pirüvat üretir. Glikoliz düzenlemesinde önemli bir nokta, yolağın ilk adımlarından olan, fosfofrüktokinaz-1 (PFK1) tarafından katalizlenen reaksiyondur. ATP düzeyi yükselince, ATP PFK1'deki bir allosterik yere bağlanıp enzim reaksiyon hızını azaltır; glikoliz inhibe olur ve ATP üretimi düşer. Bu negatif geribesleme hücredeki ATP konsantrasyonunun istikrarlı kalmasını sağlar. Ancak, metabolik yolaklar sadece inhibisyon yoluyla düzenlenmezler çünkü enzim aktivasyonu da aynı derecede önemlidir. früktoz 2,6-bisfosfat ve ADP, PFK1 durumunda allosterik aktivatör olarak etki eden metabolitlere örnektir.[33]
Spesifik protein inhibitörler ile de fizyolojik enzim inhibisyonu elde edilebilir. pek çok sindirim enzim öncülünün (prekürsörünün) üretildiği pankreasta bu mekanizma görülebilir. Bu öncüllerin çoğu, tripsin proteazı tarafından aktive edilir, bu yüzden pankreasın kendi kendini sindirmemesi için bu sindirim enzimlerinin inhibe edilmesi gereklidir. Tripsin aktivitesinin kontrol edilme yollarından biri, spesifik ve güçlü bir tripsin inhibitörünün pankreas tarafından üretimidir. Bu inhibitör tripsine sıkıca bağlanarak organ için zararlı olacak tripsin aktivitesini engeller.[34] Tripsin inhibitörü bir protein olmasına rağmen, tripsinin aktif bölgesindeki suyu dışlayarak ve reaksiyon geçiş durumunu kararsız hâle getirerek, kendisinin tripsin için substrat olmasının önüne geçer.[35] Fizyolojik enzim inhibitör proteinlerinin diğer örnekleri arasında bakteriyel ribonükleaz inhibitörü barnaz[36] ve protein fosfataz[37] inhibitörleri sayılabilir.
Pestisit ve herbisitler
[değiştir | kaynağı değiştir]Çoğu herbisit ve pestisit enzim inhibitörüdür. Asetilkolinesteraz (AChE), böceklerden insanlara kadar hayvanlarda bulunan bir enzimdir. Sinir hücrelerinin işlev görebilmesi için bu enzimin asetilkolin adlı nörotransmitteri asetat ve kolin olarak parçalaması gereklidir. Bu mekanizma nörotransmitterler arasında nispeten enderdir, çünkü çoğu diğer nörotransmitter, serotonin, dopamin ve norepinefrin dahil olmak üzere, parçalanmak yerine sinaptik boşluk tarafından absorbe edilirler. Hem tıpta hem tarımda çok sayıda AChE inhibitörleri kullanılır. Tersinir yarışmalı inhibitörler, edrophonium, fizostigmin ve neostigmin gibi, miyasteni tedavisi ve anestezi için kullanılır. Karbamat pestisitleri de tersinir AChE inhibitörlerine örnektir. Organofosfat insektisitlerden olan malatyon, paratyon ve klorpirifos tersinmez olarak asetilkolinesterazı inhibe ederler.
Glifosat herbisiti 3-fosfoşikimat 1-karboksiviniltransferaz'ın inhibitörüdür,[38] başka herbisitler ise, sülfonilüreler gibi, asetolaktat sentaz enzimini inhibe eder. Bu iki enzim de bitkiler tarafından dallı zinciri olan amino asitler yapmak için kullanılır. Herbisitler tarafından inhibe edilen pek çok başka enzim de vardır, bunların arasında lipit ve karotenoit biyosentezi, fotosentez ve oksidatif fosforilasyonda görev alan enzimler vardır.[39]

Doğal zehirler
[değiştir | kaynağı değiştir]Hayvan ve bitkiler, geniş bir zehirli ürünler yelpazesi oluşturacak şekilde evrimleşmişlerdir. Bunların arasında inhibitör etkisi olan ikincil metabolitler, peptitler ve proteinler bulunmaktadır. Doğal toksinler genelde küçük organik moleküllerdir ve o kadar çeşitlidirler ki muhetemelen çoğu metabolik süreç için doğal inhibitörler mevcuttur.[40] Doğal zehirlerin hedefi olan metabolik süreçler sadece metabolik yolaklardaki enzimler değildir, ayrıca hücredeki reseptör, kanal ve doğal fonksiyonlar da inhibe olabilir. Örneğin, paklitaksel (taksol), Pasifik porsuk ağacı'de bulunan bir organik molekül, tübülin dimerlerine sıkıca bağlanır ve onların hücre iskeletindeki mikrotübülleri oluşturmasını inhibe eder.[41]
Çoğu doğal zehir, felce ve dolayısısıyla ölüme yol açan nörotoksin olarak etkir. Bunlar avcılara karşı korunmaya veya avcı canlıların av yakalamasına yarar. Bu doğal inhibitörlerin bazıları, toksik özelliklerine rağmen, düşük dozda tedavi edici özellikleri nedeniyle tıpta değerlidir.[42] Bunun bir örneği Solanaceae ailesinden (patates, domates ve patlıcan, bu ailenin üyelerindendir) elde edilen glikoalkaloitlerdir, bunlar asetilkolinesteraz inhibitörleridir. Bu enzimin inhibisyonu asetilkolin nörotransmitterinin kontrolsuz şekilde artmasına ve bunun sonucu kas felci ve ölüme neden olur. Nörotoksisite ayrıca reseptörlerin inhibisyonu sonucu da meydana gelebilir; örneğin, zehirli güzelavrat otunda (Atropa belladonna)'da bulunan atropin, muskarinik asetilkolin reseptörünün yarışmalı agonisti olarak işlev gösterir.[43]
Çoğu doğal toksin ikincil metabolit olmakla beraber, bunların arasında peptit ve proteinler de bulunur. Toksik bir peptite örnek alpha-amanitin'dir, köygöçüren mantarının akrabalarında bulunur. Bu peptit, güçlü bir enzim inhibitörüdür, RNA polimeraz II enziminin DNA'yı çevriyazmasını (transkribe etmesini) engeller.[44] Yosun toksini mikrosistin de bir peptittir ve protein fosfatazların inhibitörüdür.[45] Bu toksin yosun patlamasından sonra su kaynaklarını kontamine edebilir, yüksek dozlarda akut karaciğer kanaması ve ölüme yol açabilen, bildik bir kanserojendir.[46]
Proteinler doğal zehir veya antigıda olabilirler. Bazı baklagillerde bulunan (ve yukarıda bahsi geçen) tripsin inhibitörleri bunun bir örneğidir. Daha ender görülen bir toksin sınıfı ise toksik enzimlerdir: bunlar, hedef enzimlerinin tersinmez inhibitörleridir ve substrat enzimlerini kimyasal olarak modifiye ederek etkirler. Bunun bir örneği olan risin, Hint yağı tohumlarında bulunan son derece güçlü bir protein toksinidir. Bu enzim, ribozomları inhibe eden bir gliyosidazdır. Risin, katalitik tersinmez bir inhibitör olduğu için, tek bir risin molekülü bir hücreyi öldürmeye yeterlidir.[47]
Ayrıca bakınız
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ Shapiro, R; Vallee, BL (1991). "Interaction of human placental ribonuclease with placental ribonuclease inhibitor". Biochemistry. 30 (8). ss. 2246-55. doi:10.1021/bi00222a030. PMID 1998683.
- ^ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. 21 Temmuz 2006 tarihinde Wayback Machine sitesinde arşivlendi. W. H. Freeman and Company ISBN 0-7167-4955-6
- ^ * Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley–Interscience; New edition (1993), ISBN 0-471-30309-7
- ^ Holdgate, GA (2001). "Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics". BioTechniques. 31 (1). ss. 164-6, 168, 170 passim. PMID 11464510.
- ^ Leatherbarrow, RJ (1990). "Using linear and non-linear regression to fit biochemical data". Trends in biochemical sciences. 15 (12). ss. 455-8. doi:10.1016/0968-0004(90)90295-M. PMID 2077683.
- ^ Tseng, SJ; Hsu, JP (1990). "A comparison of the parameter estimating procedures for the Michaelis-Menten model". Journal of theoretical biology. 145 (4). ss. 457-64. doi:10.1016/S0022-5193(05)80481-3. PMID 2246896.
- ^ a b Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley-Interscience; New Ed edition (1993), ISBN 0-471-30309-7
- ^ Dixon, M. Webb, E.C., Thorne, C.J.R. and Tipton K.F., Enzymes (3rd edition) Longman, London (1979) p. 126
- ^ Hsu, JT; Wang, HC; Chen, GW; Shih, SR (2006). "Antiviral drug discovery targeting to viral proteases". Current pharmaceutical design. 12 (11). ss. 1301-14. doi:10.2174/138161206776361110. PMID 16611117.
- ^ Lew W, Chen X, Kim CU (2000). "Discovery and development of GS 4104 (oseltamivir): an orally active influenza neuraminidase inhibitor". Curr. Med. Chem. 7 (6). ss. 663-72. PMID 10702632.
- ^ Fischer PM (2003). "The design, synthesis and application of stereochemical and directional peptide isomers: a critical review". Curr. Protein Pept. Sci. 4 (5). ss. 339-56. doi:10.2174/1389203033487054. PMID 14529528.
- ^ Bogoyevitch, MA; Barr, RK; Ketterman, AJ (2005). "Peptide inhibitors of protein kinases-discovery, characterisation and use". Biochimica et Biophysica Acta. 1754 (1-2). ss. 79-99. doi:10.1016/j.bbapap.2005.07.025. PMID 16182621.
- ^ Lundblad R. L. Chemical Reagents for Protein Modification CRC Press Inc (2004) ISBN 0-8493-1983-8
- ^ N. Price, B. Hames, D. Rickwood (Ed.) Proteins LabFax Academic Press (1996) ISBN 0-12-564710-7
- ^ Adam, GC; Cravatt, BF; Sorensen, EJ (2001). "Profiling the specific reactivity of the proteome with non-directed activity-based probes". Chemistry & biology. 8 (1). ss. 81-95. doi:10.1016/S1074-5521(00)90060-7. PMID 11182321.
- ^ Maurer, T; Fung, HL (2000). "Comparison of methods for analyzing kinetic data from mechanism-based enzyme inactivation: application to nitric oxide synthase". AAPS pharmSci. 2 (1). ss. E8. PMID 11741224.
- ^ Loo JA, DeJohn DE, Du P, Stevenson TI, Ogorzalek Loo RR (1999). "Application of mass spectrometry for target identification and characterization". Med Res Rev. 19 (4). ss. 307-19. doi:10.1002/(SICI)1098-1128(199907)19:4<307::AID-MED4>3.0.CO;2-2. PMID 10398927.
- ^ a b Poulin, R; Lu, L; Ackermann, B; Bey, P; Pegg, AE (1992). "Mechanism of the irreversible inactivation of mouse ornithine decarboxylase by alpha-difluoromethylornithine. Characterization of sequences at the inhibitor and coenzyme binding sites". The Journal of biological chemistry. 267 (1). ss. 150-8. PMID 1730582.
- ^ Szedlacsek, SE; Duggleby, RG (1995). "Kinetics of slow and tight-binding inhibitors". Methods in enzymology. Cilt 249. ss. 144-80. doi:10.1016/0076-6879(95)49034-5. PMID 7791610.
- ^ Stone, SR; Morrison, JF (1986). "Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogues". Biochimica et Biophysica Acta. 869 (3). ss. 275-85. PMID 3511964.
- ^ Pick, FM; McGartoll, MA; Bray, RC (1971). "Reaction of formaldehyde and of methanol with xanthine oxidase". European journal of biochemistry / FEBS. 18 (1). ss. 65-72. PMID 4322209.
- ^ Reardon, JE (1989). "Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition". The Journal of biological chemistry. 264 (32). ss. 19039-44. PMID 2553730.
- ^ Cohen, J.A.; Oosterbaan, R.A.; Berends, F. (1967). "[81] Organophosphorus compounds". Cilt 11. s. 686. doi:10.1016/S0076-6879(67)11085-9.
- ^ Brenner, G. M. (2000): Pharmacology. Philadelphia, PA: W.B. Saunders Company. ISBN 0-7216-7757-6
- ^ Saravanamuthu, A; Vickers, TJ; Bond, CS; Peterson, MR; Hunter, WN; Fairlamb, AH (2004). "Two interacting binding sites for quinacrine derivatives in the active site of trypanothione reductase: a template for drug design". The Journal of biological chemistry. 279 (28). ss. 29493-500. doi:10.1074/jbc.M403187200. PMID 15102853.
- ^ Koppitz M, Eis K (2006). "Automated medicinal chemistry". Drug Discov. Today. 11 (11-12). ss. 561-8. doi:10.1016/j.drudis.2006.04.005. PMID 16713909.
- ^ Scapin G (2006). "Structural biology and drug discovery". Curr. Pharm. Des. 12 (17). ss. 2087-97. doi:10.2174/138161206777585201. PMID 16796557.
- ^ Gohlke H, Klebe G (Ağustos 2002). "Approaches to the description and prediction of the binding affinity of small-molecule ligands to macromolecular receptors". Angew. Chem. Int. Ed. Engl. 41 (15). ss. 2644-76. doi:10.1002/1521-3773(20020802)41:15<2644::AID-ANIE2644>3.0.CO;2-O. PMID 12203463.
- ^ Glen RC, Allen SC (Mayıs 2003). "Ligand-protein docking: cancer research at the interface between biology and chemistry". Curr. Med. Chem. 10 (9). ss. 763-7. doi:10.2174/0929867033457809. PMID 12678780.
- ^ Maggi, M; Filippi, S; Ledda, F; Magini, A; Forti, G (2000). "Erectile dysfunction: from biochemical pharmacology to advances in medical therapy". European journal of endocrinology / European Federation of Endocrine Societies. 143 (2). ss. 143-54. PMID 10913932.
- ^ McGuire, JJ (2003). "Anticancer antifolates: current status and future directions". Current pharmaceutical design. 9 (31). ss. 2593-613. doi:10.2174/1381612033453712. PMID 14529544.
- ^ Katz, AH; Caufield, CE (2003). "Structure-based design approaches to cell wall biosynthesis inhibitors". Current pharmaceutical design. 9 (11). ss. 857-66. doi:10.2174/1381612033455305. PMID 12678870.
- ^ Okar, DA; Lange, AJ (1999). "Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes". BioFactors (Oxford, England). 10 (1). ss. 1-14. doi:10.1002/biof.5520100101. PMID 10475585.
- ^ Nicholas Price, Lewis Stevens, Fundamentals of Enzymology, Oxford University Press, (1999) ISBN 0-19-850229-X
- ^ Smyth, TP (2004). "Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors". Bioorganic & medicinal chemistry. 12 (15). ss. 4081-8. doi:10.1016/j.bmc.2004.05.041. PMID 15246086.
- ^ Hartley, RW (1989). "Barnase and barstar: two small proteins to fold and fit together". Trends in biochemical sciences. 14 (11). ss. 450-4. doi:10.1016/0968-0004(89)90104-7. PMID 2696173.
- ^ Oliver, CJ; Shenolikar, S (1998). "Physiologic importance of protein phosphatase inhibitors". Frontiers in bioscience : a journal and virtual library. Cilt 3. ss. D961-72. PMID 9727084. 9 Temmuz 2011 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2011.
- ^ Tan S, Evans R, Singh B (Mart 2006). "Herbicidal inhibitors of amino acid biosynthesis and herbicide-tolerant crops". Amino Acids. 30 (2). ss. 195-204. doi:10.1007/s00726-005-0254-1. PMID 16547651.
- ^ Duke SO (1990). "Overview of herbicide mechanisms of action". Environ. Health Perspect. Cilt 87. Brogan &. ss. 263-71. doi:10.2307/3431034. PMC 1567841 $2. PMID 1980104. 8 Haziran 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Temmuz 2011.
- ^ Tan, G; Gyllenhaal, C; Soejarto, DD (2006). "Biodiversity as a source of anticancer drugs". Current drug targets. 7 (3). ss. 265-77. doi:10.2174/138945006776054942. PMID 16515527.
- ^ Abal, M; Andreu, JM; Barasoain, I (2003). "Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action". Current cancer drug targets. 3 (3). ss. 193-203. doi:10.2174/1568009033481967. PMID 12769688.
- ^ Hostettmann, K.; Borloz, A.; Urbain, A.; Marston, A. (2006). "Natural Product Inhibitors of Acetylcholinesterase". Current Organic Chemistry. Cilt 10. s. 825. doi:10.2174/138527206776894410.
- ^ Defrates, LJ; Hoehns, JD; Sakornbut, EL; Glascock, DG; Tew, AR (2005). "Antimuscarinic intoxication resulting from the ingestion of moonflower seeds". The Annals of pharmacotherapy. 39 (1). ss. 173-6. doi:10.1345/aph.1D536. PMID 15572604.
- ^ Vetter, J (1998). "Toxins of Amanita phalloides". Toxicon : official journal of the International Society on Toxinology. 36 (1). ss. 13-24. doi:10.1016/S0041-0101(97)00074-3. PMID 9604278.
- ^ Holmes, CF; Maynes, JT; Perreault, KR; Dawson, JF; James, MN (2002). "Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins". Current medicinal chemistry. 9 (22). ss. 1981-9. PMID 12369866.
- ^ Bischoff, K (2001). "The toxicology of microcystin-LR: occurrence, toxicokinetics, toxicodynamics, diagnosis and treatment". Veterinary and human toxicology. 43 (5). ss. 294-7. PMID 11577938.
- ^ Hartley, MR; Lord, JM (2004). "Cytotoxic ribosome-inactivating lectins from plants". Biochimica et Biophysica Acta. 1701 (1-2). ss. 1-14. doi:10.1016/j.bbapap.2004.06.004. PMID 15450171.
Dış bağlantılar
[değiştir | kaynağı değiştir]- Enzim inhibisyonu hakkında animasyonlu Web eğiticisi28 Şubat 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- Enzim Kinetiği için sembol ve terminoloji, Uluslararası Biyokimya Birliği Adlandırma Komitesinin (NC-IUB) enzim inhibisyon terminolojisi hakkında önerileri (İngilizce)
- PubChem (NCBI)16 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi., İlaç ve enzim inhibitörleri veritabanı
- BRENDA 11 Aralık 2008 tarihinde Wayback Machine sitesinde arşivlendi., Enzim veritabanı; her enzim için inhibitöerler listelenmiştir.
- Enzymes, Kinetics and Diagnostic Use 9 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi., Enzim inhibitörlerinin tibbi uygulamaları hakkında konferans: Dr. Michael W. King of the IU School of Medicine (İngilizce)
- BindingDB 10 Aralık 2020 tarihinde Wayback Machine sitesinde arşivlendi., protein-ligand bağlanma afinitleri için veritabanı.
- Enzim Inhibisyonu. Animasyonlu alıştırmalar 26 Haziran 2011 tarihinde Wayback Machine sitesinde arşivlendi. (ders ve testler).(İngilizce)
