Colagen
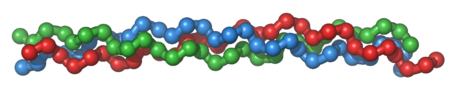
Colagenul este principala proteină structurală care se găsește în spațiul extracelular în diverse țesuturi conjunctive animale. Fiind principalul component al țesutului conjunctiv, colagenul este cea mai răspândită proteină din corpul mamiferelor, reprezentând aproximativ 25% până la 35% din cantitatea totală de proteine.[1] Structura colagenului este realizată prin împletirea a trei lanțuri polipeptidice helicoidale, care formează fibrile alungite.[2] Se găsește majoritar în țesuturi conjunctive fibroase, ca de exemplu în tendoane, ligamente și piele.
Tipuri
[modificare | modificare sursă]Există mai multe tipuri de colagen. Mai mult de 90% din colagenul prezent în corpul uman este colagen de tipul I.[3] Indiferent de tip, molecula de colagen este formată din cel puțin un triplu helix[4] Numărul mare de tipuri de colagen indică funcționalitatea foarte diversă a colagenului.[5]
Din 2011, 30 de tipuri de colagen au fost identificate, descrise și împărțite în mai multe categorii, pe baza structurii lor:[4]
- Fibrilar (tipurile I, II, III, V, XI)
- Non-fibrilar
- FACIT (engleză Fibril Associated Collagens with Interrupted Triple Helices) (tipurile IX, XII, XIV, XIX, XXI)
- Cu catenă scurtă (tipurile VIII, X)
- Membrană bazală (tipurile IV)
- Multiplexină (engleză Multiple Triple Helix domains with Interruptions) (tipurile XV, XVIII)
- MACIT (engleză Membrane Associated Collagens with Interrupted Triple Helices) (tipurile XIII, XVII)
- Formator de microfibrile (tipul VI)
- Fibrile de ancorare (tipul VII)
Cele mai comune tipuri de colagen sunt:
- Tipul I: piele, tendoane, vase, organe, oase
- Tipul II: cartilaje (componenta colagenică)
- Tipul III: țesut reticulat (componentul majoritar al fibrelor reticulare)
- Tipul IV: formează lamina bazală, stratul sintetizat de epiteliul membranei bazale
- Tipul V: suprafața celulelor, păr și placentă
Biochimie
[modificare | modificare sursă]Colagenul este alcătuit dintr-un triplu helix, care în general conține două catene identice (α1) și o catenă adițională care diferă puțin prin compoziția chimică (α2).[6] Compozitia aminoacizilor in colagen este atipică proteinelor, ceea ce se remarcă prin conținutul crescut de hidroxiprolină. Există multe secvențe repetitive de aminoacizi, cele mai comune fiind: glicină-prolină-X și glicină-X-hidroxiprolină, unde X este un aminoacid (dar nu glicină, prolină sau hidroxiprolină).[6]
Utilizări medicale
[modificare | modificare sursă]Vezi și
[modificare | modificare sursă]Referințe
[modificare | modificare sursă]- ^ Di Lullo, Gloria A.; Sweeney, Shawn M.; Körkkö, Jarmo; Ala-Kokko, Leena & San Antonio, James D. (). „Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen”. J. Biol. Chem. 277 (6): 4223–4231. doi:10.1074/jbc.M110709200. PMID 11704682.
- ^ „Leather grown using biotechnology is about to hit the catwalk”. The Economist. Arhivat din originalul de la . Accesat în .
- ^ Sabiston textbook of surgery board review, 7th edition. Chapter 5 wound healing, question 14
- ^ a b Ricard-Blum, S. (). „The Collagen Family”. Cold Spring Harbor Perspectives in Biology. 3 (1): a004978. doi:10.1101/cshperspect.a004978. PMC 3003457
. PMID 21421911.
- ^ Franzke, CW; Bruckner, P; Bruckner-Tuderman, L (). „Collagenous transmembrane proteins: recent insights into biology and pathology”. The Journal of Biological Chemistry. 280 (6): 4005–8. doi:10.1074/jbc.R400034200
. PMID 15561712.
- ^ a b Szpak, Paul (). „Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis”. Journal of Archaeological Science. 38 (12): 3358–3372. doi:10.1016/j.jas.2011.07.022. Arhivat din originalul de la .
Legături externe
[modificare | modificare sursă]- „Colagen” la DEX online

