Fórmula de Rydberg
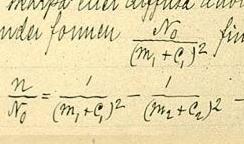
A fórmula de Rydberg (fórmula de Rydberg-Ritz) ou equação de Rydberg é utilizada em física atômica para determinar todo o espectro da luz emitida pelo hidrogênio, posteriormente estendida para uso com qualquer elemento pelo uso do princípio de combinação de Rydberg-Ritz.[1][2]
O espectro é o conjunto de comprimentos de onda dos fótons emitidos quando o elétron pula entre níveis de energia discretos, "camadas" ao redor do átomo de um certo elemento químico. A descoberta posteriormente promoveu motivação para a criação da física quântica.[3]
A fórmula foi inventada pelo físico sueco Johannes Rydberg e apresentada em 5 de Novembro de 1888.
Fórmula de Rydberg para o hidrogênio
[editar | editar código-fonte]Onde
- é o comprimento de onda da luz emitida no vácuo,[1]
- é a constante de Rydberg para o hidrogênio,[4]
- and são inteiros tais que .
Deixando igual a 1 e fazendo percorrer de 2 até o infinito, as linhas de espectro conhecidas como série de Lyman convergem em 91 nm. Da mesma maneira:
| Nome | Converge para | ||
| 1 | Série de Lyman | 91 nm | |
| 2 | Série de Balmer | 365 nm | |
| 3 | Série de Paschen | 821 nm | |
| 4 | Série de Brackett | 1459 nm | |
| 5 | Série de Pfund | 2280 nm | |
| 6 | Série de Humphreys | 3283 nm |
Apenas a série de Balmer está na faixa visível do espectro luminoso. A série de Lyman está na faixa ultravioleta, e as séries de Paschen, Brackett, Pfund, e Humphreys, na infravermelha.
Fórmula de Rydberg para qualquer elemento semelhante ao hidrogênio
[editar | editar código-fonte]A fórmula acima pode ser estendida para qualquer elemento químico semelhante ao hidrogênio.[1][4]
onde
- é o comprimento de onda da luz emitida no vácuo;
- é a constante de Rydberg para esse elemento;
- é o número atômico;
- e são inteiros tais que .
É importante notar que esta fórmula pode ser aplicada apenas para elementos semelhantes ao hidrogênio, também chamados átomos hidrogênicos ou hidrogenóides, isto é,.átomos com apenas um elétron na orbital mais externo. Exemplos destes incluem o etc.[5]
Ver também
[editar | editar código-fonte]- Princípio de combinação de Rydberg-Ritz
- Johannes Rydberg
- constante de Rydberg
- Átomo de Bohr
- Espectro do átomo de hidrogênio
- ↑ a b c Martinson, Indrek; L.J. Curtis (2005). «Janne Rydberg – his life and work» (PDF). NIM B. 235: 17–22. doi:10.1016/j.nimb.2005.03.137 (em inglês)
- ↑ Jastrow, Robert (1948). «On the Rydberg-Ritz Formula in Quantum Mechanics». Phys. Rev. 73. 60 páginas. doi:10.1103/PhysRev.73.60 (em inglês)
- ↑ ÁTOMOS DE RYDBERG
- ↑ a b O ESPECTRO DO HIDROGÊNIO
- ↑ Comprimento de rais do Hidrogênio (Lyman, Pashen, Brackett)
Bibliografia
[editar | editar código-fonte]- Mike Sutton, “Getting the numbers right – the lonely struggle of Rydberg” Chemistry World, Vol. 1, No. 7, July 2004.
- Peter W. Atkins, Loretta Jones, Principios de Química : Questionando a Vida Moderna e o Meio Ambiente, Bookman ISBN 8-540-70054-9 capítulo 1
- Yuhua Fu, Linfan Mao, and Mihaly Bencze, SCIENTIFIC ELEMENTS (International Book Series), Vol. I, Applications of Smarandache's Notions to Mathematics, Physics, and Other Sciences, Infinite Study, 2007 ISBN 1-599-73041-3 (em inglês)
- Darryl J. Leiter, Sharon Leiter, A to Z of Physicists, Infobase Publishing, 2009 ISBN 1-438-10922-9 (em inglês)