第XII因子
第XII因子(だい12いんし、英: factor XII)またはハーゲマン因子(Hageman factor)は、血漿のタンパク質である。セリンプロテアーゼ(またはセリンエンドペプチダーゼ)に分類される酵素第XIIa因子の酵素前駆体である。ヒトでは、第XII因子はF12遺伝子にコードされる[5]。
構造
[編集]ヒトの第XII因子は596アミノ酸長で、重鎖(353残基)と軽鎖(243残基)という2本の鎖がジスルフィド結合で連結された構造をしており、約80kDaである。重鎖は2つのフィブロネクチン型ドメイン(I型とII型)、2つのEGF様ドメイン、クリングルドメイン、プロリンリッチ領域を含んでおり、軽鎖はプロテアーゼドメインを含んでいる。近年、重鎖のフィブロネクチンI型ドメイン-EGF様ドメインの構造がX線結晶構造解析によって解かれた[6][7]。第XII因子の軽鎖の構造は、不活性状態と、阻害剤に結合した活性化状態が決定されている[8][9][10]。
機能
[編集]第XII因子は血液凝固カスケードの一部をなし、in vitroでは第XI因子とプレカリクレインを活性化する。第XII因子自身はガラスなどの負に帯電した表面によって第XIIa因子へと活性化され、これが内因性経路の開始点となる[要出典]。第XII因子は実験室での研究で血液凝固カスケードを開始させるためにも利用される[12]。
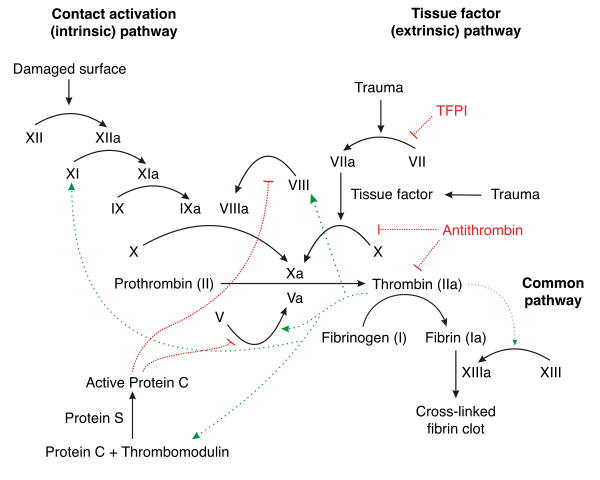
In vivoでは、第XII因子はポリアニオンとの接触によって活性化される。活性化された血小板はポリリン酸などの無機ポリマーを分泌する。ポリリン酸との接触は第XII因子を活性化し、血栓形成に重要な内因性経路を介してフィブリンの形成を開始する。ホスファターゼによるポリリン酸の標的化によって、マウスでは活性化された血小板の凝固促進活性の干渉がみられ、血小板によって誘導される血栓形成が阻害された。ヘルマンスキー・パドラック症候群の患者でみられる血漿凝固の欠陥はポリリン酸の付加によって回復し、このことはこの無機ポリマーがin vivoでの内在性第XII因子の活性化因子であることを示している。血小板のポリリン酸にって駆動される第XII因子の活性化は、一次止血(血小板血栓の形成)から二次止血(フィブリンメッシュの形成)への接続を担う[13]。
遺伝子
[編集]第XII因子の遺伝子は、5番染色体の長腕の先端(5q33-qter)に位置している[5]。
疾患における役割
[編集]第XII因子欠乏症は、常染色体劣性遺伝する希少疾患である[14]。他の凝固因子欠乏症とは異なり、第XII因子欠乏症は完全に無症候性で、過剰な出血を引き起こすことはない[14]。しかし、第XII因子の遺伝子を欠失したマウスは血栓形成に対する感受性が低い。このタンパク質は、血管壁損傷の最初の閉塞よりも血栓形成の後期の段階に関与しているようである[15]。
第XII因子はin vitroでの活性化部分トロンボプラスチン時間の測定における血栓形成に重要な役割を果たす。第XII因子欠乏症患者では活性化部分トロンボプラスチン時間の顕著な延長がみられ、通常血友病A、血友病B、第XI因子欠乏症で見られる以上に延長される[14]。そのため、第XII因子欠乏症に関する主要な懸念は、不要な検査、ケアの遅れ、不安などであり、通常ではない実験室での結果によっても促される[14]。これらはすべて、その遺伝形式も含めて、他の内因系の因子、プレカリクレイン(フレッチャー因子)と高分子キニノゲンにもあてはまる[14]。第XII因子はプラスミノゲンを活性型で線維素溶解性のプラスミンへ転換する触媒の1つであるため、静脈血栓塞栓症のリスクを高める素因となる可能性がある[16]。
第XII因子はエンドトキシン、特にリピドAによっても活性化される。
歴史
[編集]37歳の鉄道制動手ジョン・ハーゲマン(John Hageman, 1918)は出血症状がないにもかかわらず、彼のルーチンの術前血液試料が試験管内で凝血時間の延長を示した。このことから1955年に第XII因子(ハーゲマン因子)が発見された。その後、ハーゲマンは血液学者Oscar Ratnoffによる検査が行われ、ハーゲマンはこれまでに同定されていない凝固因子を欠損していることが判明した[17]。Ratnoffはハーゲマン因子欠乏症を有する関係者を調査した後、それが常染色体劣性遺伝する異常であることを発見した。逆説的なことに、ハーゲマンは1968年に業務上の事故の後に肺血栓塞栓症のために死去した。その後の症例研究と臨床研究によって、第XII因子欠乏症と血栓症との関係が示された。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000131187 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000021492 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b Cool DE, MacGillivray RT (October 1987). "Characterization of the human blood coagulation factor XII gene. Intron/exon gene organization and analysis of the 5'-flanking region". The Journal of Biological Chemistry. 262 (28): 13662–73. PMID 2888762。
- ^ Stavrou E, Schmaier AH (March 2010). "Factor XII: what does it contribute to our understanding of the physiology and pathophysiology of hemostasis & thrombosis". Thrombosis Research. 125 (3): 210–5. doi:10.1016/j.thromres.2009.11.028. PMC 2851158. PMID 20022081。
- ^ Beringer DX, Kroon-Batenburg LM (February 2013). "The structure of the FnI-EGF-like tandem domain of coagulation factor XII solved using SIRAS". Acta Crystallographica Section F. 69 (Pt 2): 94–102. doi:10.1107/S1744309113000286. PMC 3564606. PMID 23385745。
- ^ Dementiev, A; Silva, A; Yee, C; Li, Z; Flavin, MT; Sham, H; Partridge, JR (2018). “Structures of human plasma β–factor XIIa cocrystallized with potent inhibitors”. Blood Adv. doi:10.1182/bloodadvances.2018016337. PMID 29519898.
- ^ Pathak, M.; Wilmann, P.; Awford, J.; Li, C.; Hamad, B. K.; Fischer, P. M.; Dreveny, I.; Dekker, L. V. et al. (2015-04). “Coagulation factor XII protease domain crystal structure”. Journal of thrombosis and haemostasis: JTH 13 (4): 580–591. doi:10.1111/jth.12849. ISSN 1538-7836. PMC 4418343. PMID 25604127.
- ^ Pathak, Monika; Manna, Rosa; Li, Chan; Kaira, Bubacarr G.; Hamad, Badraldin Kareem; Belviso, Benny Danilo; Bonturi, Camila R.; Dreveny, Ingrid et al. (2019-06-01). “Crystal structures of the recombinant β-factor XIIa protease with bound Thr-Arg and Pro-Arg substrate mimetics”. Acta Crystallographica. Section D, Structural Biology 75 (Pt 6): 578–591. doi:10.1107/S2059798319006910. ISSN 2059-7983. PMID 31205020.
- ^ Gordon EM, Gallagher CA, Johnson TR, Blossey BK, Ilan J (April 1990). "Hepatocytes express blood coagulation factor XII (Hageman factor)". The Journal of Laboratory and Clinical Medicine. 115 (4): 463–9. PMID 2324612。
- ^ Renné T, Schmaier AH, Nickel KF, Blombäck M, Maas C (November 2012). "In vivo roles of factor XII". Blood. 120 (22): 4296–303. doi:10.1182/blood-2012-07-292094. PMC 3507141. PMID 22993391。
- ^ Müller F, Mutch NJ, Schenk WA, Smith SA, Esterl L, Spronk HM, Schmidbauer S, Gahl WA, Morrissey JH, Renné T (December 2009). "Platelet polyphosphates are proinflammatory and procoagulant mediators in vivo". Cell. 139 (6): 1143–56. doi:10.1016/j.cell.2009.11.001. PMC 2796262. PMID 20005807。
- ^ a b c d e Wagenman BL, Townsend KT, Mathew P, Crookston KP (June 2009). "The laboratory approach to inherited and acquired coagulation factor deficiencies". Clinics in Laboratory Medicine. 29 (2): 229–52. doi:10.1016/j.cll.2009.04.002. PMID 19665676。
- ^ Renné T, Pozgajová M, Grüner S, Schuh K, Pauer HU, Burfeind P, Gailani D, Nieswandt B (July 2005). "Defective thrombus formation in mice lacking coagulation factor XII". The Journal of Experimental Medicine. 202 (2): 271–81. doi:10.1084/jem.20050664. PMC 2213000. PMID 16009717。
- ^ Kroll, Michael H. (2001). Manual of Coagulation Disorders. Blackwell Science. pp. 3–4, 206–207. ISBN 0-86542-446-2
- ^ Ratnoff OD, Margolius A (1955). "Hageman trait: an asymptomatic disorder of blood coagulation". Transactions of the Association of American Physicians. 68: 149–54. PMID 13299324。
関連文献
[編集]- Girolami A, Randi ML, Gavasso S, Lombardi AM, Spiezia F (April 2004). "The occasional venous thromboses seen in patients with severe (homozygous) FXII deficiency are probably due to associated risk factors: a study of prevalence in 21 patients and review of the literature". Journal of Thrombosis and Thrombolysis. 17 (2): 139–43. doi:10.1023/B:THRO.0000037670.42776.cd. PMID 15306750。
- Renné T, Gailani D (July 2007). "Role of Factor XII in hemostasis and thrombosis: clinical implications". Expert Review of Cardiovascular Therapy. 5 (4): 733–41. doi:10.1586/14779072.5.4.733. PMID 17605651。
- Harris RJ, Ling VT, Spellman MW (March 1992). "O-linked fucose is present in the first epidermal growth factor domain of factor XII but not protein C". The Journal of Biological Chemistry. 267 (8): 5102–7. PMID 1544894。
- McMullen BA, Fujikawa K, Davie EW (February 1991). "Location of the disulfide bonds in human plasma prekallikrein: the presence of four novel apple domains in the amino-terminal portion of the molecule". Biochemistry. 30 (8): 2050–6. doi:10.1021/bi00222a007. PMID 1998666。
- Miyata T, Kawabata S, Iwanaga S, Takahashi I, Alving B, Saito H (November 1989). "Coagulation factor XII (Hageman factor) Washington D.C.: inactive factor XIIa results from Cys-571----Ser substitution". Proceedings of the National Academy of Sciences of the United States of America. 86 (21): 8319–22. doi:10.1073/pnas.86.21.8319. PMC 298272. PMID 2510163。
- Bernardi F, Marchetti G, Patracchini P, del Senno L, Tripodi M, Fantoni A, Bartolai S, Vannini F, Felloni L, Rossi L (May 1987). "Factor XII gene alteration in Hageman trait detected by TaqI restriction enzyme". Blood. 69 (5): 1421–4. PMID 2882793。
- Cool DE, MacGillivray RT (October 1987). "Characterization of the human blood coagulation factor XII gene. Intron/exon gene organization and analysis of the 5'-flanking region". The Journal of Biological Chemistry. 262 (28): 13662–73. PMID 2888762。
- Que BG, Davie EW (April 1986). "Characterization of a cDNA coding for human factor XII (Hageman factor)". Biochemistry. 25 (7): 1525–8. doi:10.1021/bi00355a009. PMID 3011063。
- Royle NJ, Nigli M, Cool D, MacGillivray RT, Hamerton JL (March 1988). "Structural gene encoding human factor XII is located at 5q33-qter". Somatic Cell and Molecular Genetics. 14 (2): 217–21. doi:10.1007/BF01534407. PMID 3162339。
- Citarella F, Tripodi M, Fantoni A, Bernardi F, Romeo G, Rocchi M (December 1988). "Assignment of human coagulation factor XII (fXII) to chromosome 5 by cDNA hybridization to DNA from somatic cell hybrids". Human Genetics. 80 (4): 397–8. doi:10.1007/BF00273661. PMID 3198120。
- Henry ML, Everson B, Ratnoff OD (May 1988). "Inhibition of the activation of Hageman factor (factor XII) by beta 2-glycoprotein I". The Journal of Laboratory and Clinical Medicine. 111 (5): 519–23. PMID 3361230。
- Chung DW, Fujikawa K, McMullen BA, Davie EW (May 1986). "Human plasma prekallikrein, a zymogen to a serine protease that contains four tandem repeats". Biochemistry. 25 (9): 2410–7. doi:10.1021/bi00357a017. PMID 3521732。
- Tripodi M, Citarella F, Guida S, Galeffi P, Fantoni A, Cortese R (April 1986). "cDNA sequence coding for human coagulation factor XII (Hageman)". Nucleic Acids Research. 14 (7): 3146. doi:10.1093/nar/14.7.3146. PMC 339730. PMID 3754331。
- Cool DE, Edgell CJ, Louie GV, Zoller MJ, Brayer GD, MacGillivray RT (November 1985). "Characterization of human blood coagulation factor XII cDNA. Prediction of the primary structure of factor XII and the tertiary structure of beta-factor XIIa". The Journal of Biological Chemistry. 260 (25): 13666–76. PMID 3877053。
- McMullen BA, Fujikawa K (May 1985). "Amino acid sequence of the heavy chain of human alpha-factor XIIa (activated Hageman factor)". The Journal of Biological Chemistry. 260 (9): 5328–41. PMID 3886654。
- de Grouchy J, Turleau C (1975). "Tentative localization of a Hageman (Factor XII) locus on 7q, probably the 7q35 band". Humangenetik. 24 (3): 197–200. doi:10.1007/bf00283584. PMID 4140832。
- Fujikawa K, McMullen BA (September 1983). "Amino acid sequence of human beta-factor XIIa". The Journal of Biological Chemistry. 258 (18): 10924–33. PMID 6604055。
- Hovinga JK, Schaller J, Stricker H, Wuillemin WA, Furlan M, Lämmle B (August 1994). "Coagulation factor XII Locarno: the functional defect is caused by the amino acid substitution Arg 353-->Pro leading to loss of a kallikrein cleavage site". Blood. 84 (4): 1173–81. PMID 8049433。
- Schloesser M, Hofferbert S, Bartz U, Lutze G, Lämmle B, Engel W (July 1995). "The novel acceptor splice site mutation 11396(G-->A) in the factor XII gene causes a truncated transcript in cross-reacting material negative patients" (PDF). Human Molecular Genetics. 4 (7): 1235–7. doi:10.1093/hmg/4.7.1235. PMID 8528215。
- Hofferbert S, Müller J, Köstering H, von Ohlen WD, Schloesser M (June 1996). "A novel 5'-upstream mutation in the factor XII gene is associated with a TaqI restriction site in an Alu repeat in factor XII-deficient patients". Human Genetics. 97 (6): 838–41. doi:10.1007/BF02346200. PMID 8641707。
外部リンク
[編集]- ペプチダーゼとその阻害因子に関するMEROPSオンラインデータベース: S01.211
- Factor XII - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス




