Quinona
As quinonas son un tipo de composto orgánico que formalmente "deriva de compostos aromáticos [como o benceno ou naftaleno] por conversión dun número impar de grupos –CH= en grupos –C(=O)– con todos os rearranxos necesarios dos dobres enlaces", orixinando "unha estrutura diona cíclica completamente conxugada".[1] Esta clase de compostos inclúe algúns compostos heterociclicos.
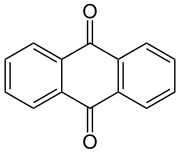
O membro arquetípico da clase é a 1,4-benzoquinona ou ciclohexadienodiona, a miúdo chamada simplemente "quinona" (igual que o nome de toda a clase). Outros exemplos importantes son a 1,2-benzoquinona (orto-quinona), a 1,4-naftoquinona e a 9,10-antraquinona.
Propiedades
[editar | editar a fonte]As quinonas son derivados oxidados de compostos aromáticos e adoitan sintetizarse doadamente a partir de compostos aromáticos reactivos con substituíntes doantes de electróns como os fenois e catecois, que incrementan a nucleofilicidade do anel e contribúen ao elevado potencial redox necesario para romper a aromaticidade. (As quinonas son compostos conxugados pero non aromáticos). As quinonas son aceptores de Michael electrofílicos estabilizados por conxugación. Dependendo da quinona e do sitio de redución, a redución pode rearomatizar o composto ou romper a conxugación. A adición conxugada case sempre rompe a conxugación.
O termo quinona utilízase tamén máis xeralmente para unha gran clase de compostos formalmente derivados de quinonas aromáticas por substitución dalgúns átomos de hidróxeno por outros átomos ou radicais.
-
Cloranil, un reactivo de química orgánica
-
Alizarina, unha tinguidura vermella común
-
DDQ, un reactivo en química orgánica
-
Daunorrubicina, un fármaco anticancro
Usos
[editar | editar a fonte]Produción de peróxido de hidróxeno
[editar | editar a fonte]Unha aplicación a escala industrial das quinonas é a produción de peróxido de hidróxeno. As 2-alquilantraquinonas son hidroxenadas ás correspondentes hidroquinonas (quinizarinas), as cales despois transfiren H
2 ao oxíxeno:
- dihidroantraquinona + O
2 → antraquinona + H
2O
2
deste modo prodúcense varios millóns de toneladas de H
2O
2 anualmente.[2]
Bioquímica
[editar | editar a fonte]Os derivados de quinonas son moléculas con actividade biolóxica comúns. Pénsase que se encontran en todos os organismos respiratorios.[3] Algúns serven como aceptores de electróns en cadeas de transporte electrónico como as da fotosíntese (plastoquinona, filoquinona), e a respiración aerobia (ubiquinona). A filoquinona tamén se chama vitamina K1 e é utilizada polos animais para carboxilar certas proteínas, que están implicadas na coagulación do sangue, formación do óso e outros procesos. Inversamente, a toxicidade do paracetamol débese ao seu metabolismo coa quinona imina, a cal reacciona despois con proteínas do fígado e causa insuficiencia hepática.
No spray que dispara o escaravello bombardeiro, a hidroquinona reacciona co peróxido de hidróxeno producindo un forte estoupido de vapor, que serve para disuadir outros animais.
A autooxidación do neurotransmisor dopamina e o seu precursor L-Dopa xera as comparativamente estables dopamina quinonas, que inhiben o funcionamento do transportador de dopamina (DAT) e o encima TH, o que orixina unha baixa produción de ATP nas mitocondrias.[4]
Medicina
[editar | editar a fonte]Varias quinonas son de interese farmacolóxico. Forman unha clase importante de citotoxinas, usadas na loita contra o cancro. Un exemplo é a daunorrubicina, que é antileucémica.[3] Algunhas delas mostran actividade antitumoral. Tamén se lles teñen atribuído propiedades en herboristería. Estas aplicacións son purgativas (sennosides), antimicrobianas e antiparasitarias (rhein e saprortoquinona, atovaquona), antitumorais (emodina e juglona), inhibición da biosíntese de PGE2 (arnebinona e arnebifuranona) e anti-enfermidades cardiovasculares (tanshinona).[5]
Tinguidura
[editar | editar a fonte]Moitas substancias colorantes naturais e artificiais (tinguiduras e pigmentos) son derivados de quinonas. En importancia como colorantes son os segundos en importancia despois das tinturas azo, especialmente importantes para as cores azuis. A alizarina (1,2-dihidroxi-9,10-antraquinona), extraída da planta Rubia, foi a primeira tintura natural que se sintetizou a partir de brea de carbón.
Reactivo en química orgánica
[editar | editar a fonte]A benzoquinona utilízase en química orgánica como axente oxidante. Quinonas fortemente oxidantes son o cloranil e a 2,3-dicloro-5,6-diciano-1,4-benzoquinona (tamén coñecida como DDQ).[6]
Portador de cargas de batería
[editar | editar a fonte]O ácido 9,10-antraquinona-2,7-disulfónico (AQDS), unha quinona similar a outra que se atopa de forma natural no ruibarbo, tense utilizado como portador de cargas en baterías de fluxo sen metais.[7]
Nomenclatura
[editar | editar a fonte]As quinonas denomínanse usando un prefixo que indica o hidrocarburo aromático parental ("benzo-" para o benceno, "nafto-" para o naftaleno, "antra-" para o antraceno, etc.) e o sufixo "-quinona". Utilízanse infixos multiplicadores como "-di-", "-tri-", "-tetra-", etc. cando hai 4, 6, 8, etc. carbonilos. A posición dos grupos carbonilo pode indicarse antes do prefixo (como na "1,4,5,8-naftodiquinona") ou despois (como na "antra-1,4-quinona").
Notas
[editar | editar a fonte]- ↑ "Quinones". Compendium of Chemical Terminology (the "Gold Book") (2ª ed.). IUPAC. (2006–) [1997].
- ↑ Gustaaf Goor, Jürgen Glenneberg, Sylvia Jacobi "Hydrogen Peroxide" in Ullmann's Encyclopedia of Industrial Chemistry 2007, Wiley-VCH, Weinheim. doi 10.1002/14356007.a13_443.pub2 10.1002/14356007.a13_443.pub2.
- ↑ 3,0 3,1 O'Brien, P.J. (1991). "Molecular mechanisms of quinone cytotoxicity". Chemico-Biological Interactions 80 (1): 1–41. PMID 1913977. doi:10.1016/0009-2797(91)90029-7.
- ↑ Dorszewska, Jolanta; Prendecki, Michal; Kozubski, Margarita Lianeri and Wojciech (2014-01-31). "Molecular Effects of L-dopa Therapy in Parkinson's Disease". Current Genomics (en inglés) 15 (1): 11–17. PMC 3958954. PMID 24653659. doi:10.2174/1389202914666131210213042.
- ↑ Liu H., "Extraction and Isolation of Compounds from Herbal Medicines" in 'Traditional Herbal Medicine Research Methods', ed by Willow JH Liu 2011 John Wiley and Sons, Inc.
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ Huskinson, Brian; Marshak, Michael P.; Suh, Changwon; Er, Süleyman; Gerhardt, Michael R.; Galvin, Cooper J.; Chen, Xudong; Aspuru-Guzik, Alán; Gordon, Roy G.; Aziz, Michael J. (9 January 2014). "A metal-free organic-inorganic aqueous flow battery" (PDF). Nature 505 (7482): 195–198. Bibcode:2014Natur.505..195H. PMID 24402280. doi:10.1038/nature12909.
Véxase tamén
[editar | editar a fonte]Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Quinones Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.