Portail:Matériaux/Lumière sur
<--Si vous désirez rajouter un ou des articles, il faut le faire à deux endroits :
- Dans les arguments du modèle « Wikipédia:Lumière sur/Au hasard » ci-dessous ;
- Dans la table ci-dessous ;
Les mini-articles de présentation doivent être créés dans « Wikipédia:Sélection/ », par exemple Wikipédia:Sélection/Linux pour le premier article sélectionné de l'exemple ci-dessous, et dont le texte contient un lien en gras qui pointe vers Linux.-->

La houille est une roche carbonée sédimentaire correspondant à une qualité spécifique de charbon, intermédiaire entre la lignite et l'anthracite (soit 80 à 90 % de carbone). De couleur noirâtre, elle provient de la carbonisation d'organismes végétaux et peut donc servir de combustible fossile. Ce combustible est utilisé depuis le XIe siècle et son extraction dans les mines a rendu possible la révolution industrielle au XIXe siècle.
La houille est surtout utilisée actuellement :
- dans les centrales thermiques utilisées pour la production d'électricité ou le chauffage urbain ;
- dans la sidérurgie, essentiellement pour la fabrication du coke utilisé dans les hauts-fourneaux; entre 600 et 700 kg de charbon sont nécessaires pour produire une tonne d'acier ;
- le chauffage individuel au charbon est en recul par rapport à d'autres sources d'énergie.
L'utilisation du charbon dans les centrales thermiques est très importante ; ces centrales fournissent 40 % de la production mondiale d'électricité, la moitié aux États-Unis et en Allemagne.
|
Les semi-conducteurs sont des matériaux présentant une conductivité électrique intermédiaire entre les métaux et les isolants. Les propriétés d'un semi-conducteur (c'est-à-dire le nombre de porteurs, électrons ou trous) peuvent être contrôlées en le dopant avec des impuretés (autres matériaux). Un semi-conducteur présentant plus d'électrons que de trous est alors dit de type N, tandis qu'un semiconducteur présentant plus de trous que d'électrons est dit de type P. |
 L’or est un élément chimique de symbole Au et de numéro atomique 79. C’est un métal de transition jaune brillant, très ductile et malléable. L’or est un métal noble : il est pauvre en électrons disponibles pour former des liaisons chimiques, dits électrons de valence. L’or se trouve à l'état natif sous forme de pépites ou d’alluvions fluviatiles. En 1995, les réserves d'or dans les banques du monde entier étaient estimées à 910 millions d'onces, ce qui représente un cube d'environ 12 mètres de côté. L’art du travail de l'or est l’orfèvrerie.
|
 Un métal est un élément chimique qui peut former des liaisons métalliques et perdre des électrons pour former des cations (ions positifs) (et des liaisons ioniques dans le cas des alcalins). Les métaux sont un des trois groupes d'éléments distingués par leurs propriétés d'ionisation et de liaison chimique ; les deux autres sont les métalloïdes et les non-métaux. Les métaux sont en général des solides cristallins. Ils sont en général malléables et ductiles. Les métaux possédent des bandes de valence et de conduction qui se recouvrent et conduisent généralement bien l'électricité et la chaleur. |
 L'acier, apparu avec l'évolution de la métallurgie, vers 1786, est un alliage composé essentiellement de fer, contenant jusqu'à 1,7 % de carbone en masse (au-delà, on parle de fonte), et éventuellement d'autres éléments. L'acier s'élabore dans un haut-fourneau, à partir du minerai de fer et de coke avec réduction du carbone dans un convertisseur, ou dans un four électrique, à partir d'acier de récupération. Il a de nombreuses applications dans l'automobile, la construction, l'emballage (...), et c'est un matériau recyclable à l'infini (illustration : bas-fourneau au Moyen-Âge.).
|
 Un diagramme de phase est une expression utilisée en thermodynamique (voir Phase) ; elle indique une représentation graphique, généralement à deux ou trois dimensions, représentant les domaines de l'état physique (ou phase) d'un système (corps pur ou mélange de corps purs), en fonction de variables, choisies pour faciliter la compréhension des phénomènes étudiés. Les diagrammes les plus simples concernent un corps pur avec pour variables la température et la pression ; les autres variables souvent utilisées sont l'enthalpie, l'entropie, le volume massique, ainsi que la concentration en masse ou en volume d'un des corps purs constituant un mélange. Lorsque le système étudié est un mélange de n corps purs, son état physique est défini par les (n-1) proportions indépendantes de ses composants, ainsi que par la température et la pression. Ainsi, un diagramme à deux variables ne peut donc être établi qu'en fixant (n-1) variables du système. C'est un diagramme à l'équilibre qui ne permet pas de décrire un système dans un état métastable comme, par exemple, de l'eau liquide à une température inférieure à 0 °C à la pression atmosphérique normale (surfusion).
|
 L'aluminium est un élément chimique, de symbole Al et de numéro atomique 13. C’est un métal pauvre, malléable, de couleur argentée. Il est remarquable pour sa résistance à l’oxydation et sa faible densité. C'est le métal le plus abondant de l'écorce terrestre et le troisième élément le plus abondant après l'oxygène et le silicium ; il représente en moyenne 8 % de la masse des matériaux de la surface solide de notre planète. L'aluminium est trop réactif pour exister à l'état natif dans le milieu naturel : on le trouve au contraire sous forme combinée dans plus de 270 minéraux différents, son minerai principal étant la bauxite, où il est présent sous forme d’oxyde hydraté dont on extrait l’alumine. Il peut aussi être extrait de la néphéline, de la leucite, de la sillimanite, de l'andalousite et de la muscovite. L'aluminium métallique est très oxydable, mais est immédiatement passivé par une fine couche d'alumine Al2O3 imperméable de quelques micromètres d'épaisseur qui protège la masse métallique de la corrosion. On parle de protection cinétique, par opposition à une protection thermodynamique, car l’aluminium reste en tout état de cause très sensible à l'oxydation. Cette résistance à la corrosion et sa remarquable légèreté en ont fait un matériau très utilisé industriellement. L'aluminium est un produit industriel important, sous forme pure ou alliée, notamment dans l'aéronautique, les transports et la construction. Sa nature réactive en fait également un catalyseur et un additif dans l'industrie chimique ; il est ainsi utilisé pour accroître la puissance explosive du nitrate d'ammonium. |
 Synthétisé pour la première fois à la fin du VIIIe siècle par l'alchimiste Jabir Ibn Hayyan, l'acide nitrique est un composé chimique liquide très corrosif. C'est un acide fort, généralement utilisé en solution aqueuse, communément appelée eau-forte par les alchimistes puis les graveurs sur cuivre. Utilisé jusqu'à la fin des années 1980 comme comburant des mélanges de propergols pour les moteurs-fusées, il est désormais principalement utilisé pour fabriquer des engrais comme le nitrate d’ammonium. C'est également l'un des composants des pluies acides.
|
 Les indices de Miller sont une manière de désigner les plans dans un cristal. On utilise des indices similaires pour désigner les directions dans un cristal, les indices de direction. Un cristal est un empilement ordonné d'atomes, d'ions ou de molécules, appelés ci-après « motifs ». La périodicité du motif est exprimée par un réseau constitué de nœuds qui représentent les sommets de la maille. Les arêtes de la maille conventionnelle définissent les vecteurs de la base. Les plans et directions sont qualifiés de « nodaux » (plan nodal, direction nodale) ou mieux encore « réticulaires ». Une direction réticulaire est dite rangée. En métallurgie, on travaille fréquemment avec des cristaux constitués d'un seul type d'atomes ; on parle donc de « plan atomique », de « direction atomique » ou de « rangée d'atomes », mais ce ne sont que des cas particuliers. Le cristal n'est pas isotrope, il n'y a pas de raison que ses propriétés le soient. Les lignes et plans de grande densité vont présenter des propriétés particulières : en optique, la vitesse de propagation de la lumière peut différer selon la direction, provoquant la biréfringence ; plan de clivage : la surface libre est plus stable si elle correspond à un plan de grande densité ; adsorption et réactivité : le nombre de sites d'adsorption, et donc la réactivité chimique, dépend de la densité d'atomes ; dislocations : les glissements se font préférentiellement selon des plans denses, etc.
|
 La microsonde de Castaing (en anglais electron probe microanalyser, EPMA) est une méthode d'analyse élémentaire inventée en 1951 par Raimond Castaing. Elle consiste à bombarder un échantillon avec des électrons et à analyser le spectre des rayons X émis par l'échantillon sous cette sollicitation. Lors du bombardement d'un échantillon, certains électrons cèdent une partie de leur énergie cinétique à l'atome, provoquant l'éjection d'un électron de l'atome ; l'atome est dit « excité ». Si l'électron éjecté est proche du cœur, un électron d'une couche périphérique va descendre vers une couche d'énergie plus faible (l'atome se désexcite), et ce faisant, il va émettre un photon. Du fait de l'énergie de transition, ce photon va appartenir au domaine des rayons X. L'énergie h.ν du photon X, généré par la désexcitation de l'atome suite au départ d'un électron secondaire, est caractéristique des transitions électroniques de l'atome et donc de sa nature chimique. On parle de « raie d'émission caractéristique ». Pour distinguer les diverses raies émises par un atome, on utilise la notation de Siegbahn ; dans cette notation, la raie Kα1 désigne une transition du niveau L3 vers le niveau K. Les éléments légers (faible numéro atomique Z) émettent des photons X de faible énergie, qui sont facilement absorbés par les autres atomes et notamment par la fenêtre en béryllium qui protège le détecteur. De plus, les éléments légers ont tendance à se désexciter en émettant un électron Auger plutôt qu'un photon X. Ces deux faits font que les intensités des raies émises par les éléments légers sont de faible intensité, leur détection et leur quantification sont de fait très difficiles. |
 L'épitaxie est une technique de croissance orientée, l'un par rapport à l'autre, de deux cristaux possédant un certain nombre d'éléments de symétrie communs dans leurs réseaux cristallins. On distingue l'homo-épitaxie, qui consiste à faire croître un cristal sur un cristal de nature chimique identique, et l'hétéro-épitaxie, dans laquelle les deux cristaux sont de natures chimiques différentes. L'épitaxie est utilisée pour faire croître des couches minces (quelques nanomètres d'épaisseur). On utilise pour cela une surface parfaitement polie d'un monocristal, le substrat, sur lequel seront déposés d'autres atomes. Le substrat est choisi de façon à avoir des paramètres de maille proches de ceux du cristal que l'on veut obtenir. L'épitaxie en phase liquide utilise le principe de la méthode de Czochralski. Le substrat est mis en contact avec une phase liquide sursaturée en l'élément voulu, qui se précipite et cristallise sur le substrat. Cette technique a l'avantage d'être rapide, mais elle est moins précise que les épitaxies en phase vapeur. L'épitaxie par jet moléculaire s'effectue sous ultra vide. Les éléments à déposer, contenus dans des creusets à haute température, sont évaporés et vont se déposer par transport thermique sur la surface du substrat, plus froide mais de température quand même assez élevée pour permettre le déplacement et le réarrangement des atomes. Les applications de l'épitaxie sont multiples : jonctions semi-conductrices, wafers pour la micro-électronique, Silicon On Insulator...
|
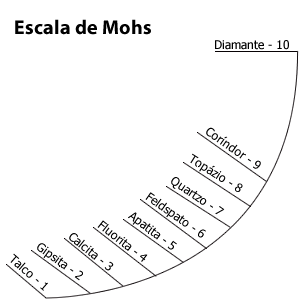 L'échelle de dureté de Mohs fut inventée en 1812 par le minéralogiste allemand Friedrich Mohs afin de mesurer la dureté des minéraux. Elle est basée sur dix minéraux facilement disponibles. Comme c'est une échelle ordinale, on doit procéder par comparaison (capacité de l'un à rayer l'autre) avec deux autres minéraux dont on connaît déjà la dureté. Cette échelle n'est ni linéaire ni logarithmique. Les dix minéraux de l'échelle de Mohs sont 1 (talc), 2 (gypse), 3 (calcite), 4 (fluorine), 5 (apatite), 6 (orthose), 7 (quartz), 8 (topaze), 9 (corindon) et 10 (diamant). Il existe aussi une échelle comportant 15 classes, destinée à remédier au manque de régularité de l'échelle de Mohs. Il existe plusieurs échelles de dureté expérimentales dont les degrés sont déterminés expérimentalement par indentation (au moyen d'un poinçon de diamant de forme déterminée). On pourra citer par exemple l'échelle de Knoop, l'échelle de Brinell, l'échelle de Rockwell, etc. qui sont appliquées en fonction des matériaux étudiés. Il existe enfin des classifications absolues en fonction de paramètres physiques précis (module de compressibilité ou module de cisaillement). |
 La corrosion aqueuse est un phénomène dont l’impact économique est très important, nécessitant une grande variété de moyens de protection des métaux. La corrosion désigne l’altération par l’environnement d’un objet manufacturé. Les exemples les plus connus sont les altérations chimiques des métaux dans l’eau (avec ou sans oxygène), telles la rouille du fer et de l’acier ou la formation de vert-de-gris sur le cuivre et ses alliages (bronze, laiton). Ces altérations chimiques, le plus souvent des oxydo-réductions, sont regroupées sous le terme de corrosion aqueuse. Elles sont dues à des effets de plusieurs sortes : dissolution des métaux dans l’eau, apparition de piles électrochimiques, existence de gradients de concentration, aération différentielle ou piqûration. |
 Les polythiophènes (PT) constituent une famille de polymères (macromolécules) résultant de la réaction de polymérisation du thiophène, un hétérocycle sulfuré, qui peut devenir conducteur lorsque des électrons sont ajoutés ou enlevés des orbitales p conjuguées par dopage. La propriété la plus remarquable de ces matériaux, la conductivité électrique, est une résultante de la délocalisation électronique le long de la chaîne polymère - d'où parfois leur qualification de « métaux synthétiques ». Cependant, elle ne constitue pas la seule propriété intéressante due à cette délocalisation des électrons. Les propriétés optiques dépendent en effet des stimuli environnementaux, avec des modifications drastiques de couleur selon le solvant, la température, le potentiel appliqué, et les liaisons à d'autres molécules. Les changements de couleurs et de conductivité sont induits par le même mécanisme - la torsion du squelette polymère, rompant la conjugaison - ce qui fait d'eux des capteurs chimiques donnant une large gamme de réponses électroniques et optiques. |
 Un nanotube est une structure cristalline particulière, de forme tubulaire, creuse et close, composée d'atomes disposés régulièrement en pentagones, hexagones et/ou heptagones, obtenue à partir de certains matériaux, en particulier le carbone et nitrure de bore. Proches des fullerènes, les nanotubes de carbone sont l'un des premiers produits industriels du domaine des nanotechnologies. Ils permettent de réaliser des transistors à un niveau de miniaturisation jamais atteint jusqu'à maintenant. Lire l'article |
 L'atome est un composant de la matière. Le mot provient du grec ατομος, atomos, « que l'on ne peut diviser » et certains philosophes de la Grèce antique le définissaient comme le plus petit élément indivisible de la matière. La notion d'atome est maintenant largement utilisée dans les diverses théories permettant d'expliquer les propriétés de la matière. En chimie, l'atome est l'élément de base : les atomes restent indivisibles au cours d'une réaction chimique. Cependant, depuis le début du XXe siècle, des expériences de physique nucléaire ont mis en évidence une structure complexe de son noyau. C'est en transformant cette structure que l'on peut, par exemple, produire l'énergie nucléaire. La majeure partie de la masse de l'atome se trouve concentrée dans le noyau composé de deux sortes de particules semblables, appelées nucléons (les neutrons et les protons). Autour du noyau se trouve « un nuage » de particules identiques : les électrons ; ce nuage électronique est environ 100 000 fois plus grand que le noyau. Le comportement de l'atome et de ses constituants est régi par les lois de la mécanique quantique.
|
 Une macle est une association orientée de deux ou plusieurs cristaux identiques, dits individus, reliés par une opération de groupe ponctuel de symétrie. L'opération qui transforme l'orientation d'un individu d'une macle en celle d'un autre individu est dite opération de macle. Celle-ci est effectuée autour d'un élément géométrique du réseau de la macle, qui est dit élément de macle : les individus de la macle sont alors symétriques par rapport à l'élément de macle. Les macles sont ainsi classées en trois catégories :
On peut aussi classer les macles
Parmi les macles les plus connues, on peut citer : les macles de Carlsbad, dans les feldspaths ; les macles du Dauphiné, du Brésil et de la Gardette dans le quartz ; les macles à croix dans la staurotide... |
 La bauxite est une roche latéritique blanche, rouge ou grise, caractérisée par sa forte teneur en alumine Al2O3 et en oxydes de fer. Cette roche constitue le principal minerai permettant la production d'aluminium. Elle se forme par altération continentale en climat chaud et humide. De structure variée, elle contient dans des proportions variables des hydrates d'alumine, de la kaolinite, de la silice et des oxydes de fer qui lui confèrent souvent une coloration rouge. Ses minéraux spécifiques sont les hydrates d'alumine comme les polymorphes de Al(OH)3 (bayérite et gibbsite, monocliniques) et ceux de AlO(OH) (diaspore et boehmite, orthorhombiques). Cette altérite n'est considérée comme minerai d'aluminium que si sa teneur en silice totale ne franchit pas un seuil variable selon les coûts du procédé d'extraction de l'alumine (procédé Bayer), puis de la transformation de l'alumine en aluminium par électrolyse. En règle générale, ces teneurs limites en silice ne dépassent pas 8 % et en aucun cas ne peuvent dépasser 15 %, valeur pour laquelle les hydrates d'alumine sont instables au profit de la kaolinite. Par démantèlement, cette roche résiduelle donne naissance à diverses autres roches de type sédimentaire que ce soit en milieu marin ou continental, voire souterrain par soutirage dans leur substrat carbonaté par dissolution de ce dernier (aramonite). |
 L'acide chlorhydrique est une solution aqueuse de chlorure d'hydrogène HCl. C'est un acide fort (il s'ionise totalement en solution aqueuse), principal constituant des acides gastriques. C'est un acide couramment utilisé comme réactif chimique dans l'industrie. L'acide chlorhydrique étant un liquide très corrosif, il doit être manié avec précaution. L'acide chlorhydrique concentré peut avoir un pH inférieur à 1. L'acide chlorhydrique, connu également dans l'histoire sous le nom d'acide muriatique (ce nom est antérieur à la découverte du chlore et de la formule chimique HCl) a été découvert par l'alchimiste Jabir Ibn Hayyan au voisinage de l'an 800. C'est un produit chimique qui a été fréquemment utilisé dans l'histoire depuis les débuts de la chimie. Au Moyen Âge, il était utilisé par les alchimistes dans leur quête de la pierre philosophale (sous le nom d'« esprit de sel » ou acidum salis). Il fut ensuite utilisé par de nombreux scientifiques, parmi lesquels Glauber, Priestley ou Davy, qui contribuèrent à établir la chimie moderne. Au cours de la révolution industrielle, l'acide chlorhydrique devint un réactif chimique industriel important utilisé dans de nombreuses applications, notamment pour la production à grande échelle de composés organiques comme le chlorure de vinyle pour le PVC, ou comme le 4,4'-MDI/Diisocyanate de toluène pour le polyuréthane, ainsi que pour des applications à plus petite échelle comme la production de gélatine ou le traitement du cuir. La production d'acide chlorhydrique est voisine à l'heure actuelle de 20 millions de tonnes par an. |
 En chimie du solide, l'isomorphisme ou isomorphotropie est la faculté de composés différents de cristalliser avec des mailles de même symétrie et dont les paramètres sont proches, ce qui leur permet de former des cristaux mixtes. Dans le cas des minéraux, une substitution isomorphe peut concerner le remplacement d'un cation par un autre de charge différente. La loi de l'isomorphisme fut découverte par Eilhard Mitscherlich en 1819. Ses investigations, en 1826, sur les deux formes cristallines du soufre le conduisent à constater, par analogie, que la calcite et l’aragonite ont la même formule chimique, pas la même forme cristalline, et donc qu’il s’agit de polymorphisme : c’est le nom qu’il donne à cette propriété de certains cristaux. L’isomorphisme est classé en quatre espèces :
|
 La houille est une roche carbonée sédimentaire correspondant à une qualité spécifique de charbon, intermédiaire entre la lignite et l'anthracite (soit 80 à 90 % de carbone). De couleur noirâtre, elle provient de la carbonisation d'organismes végétaux et peut donc servir de combustible fossile. Ce combustible est utilisé depuis le XIe siècle et son extraction dans les mines a rendu possible la révolution industrielle au XIXe siècle. La houille est surtout utilisée actuellement :
L'utilisation du charbon dans les centrales thermiques est très importante ; ces centrales fournissent 40 % de la production mondiale d'électricité, la moitié aux États-Unis et en Allemagne. |
 Un polariseur est un outil qui convertit la polarisation d'une onde lumineuse en un certain état de polarisation : la plupart des polariseurs permettent d'obtenir une lumière polarisée rectilignement dans une certaine direction. Dans ce cas, cette direction est appelée l'axe du polariseur. Les polariseurs sont présents dans de nombreuses expériences d'optique et sont donc utilisés dans des instruments d'optique. Ils sont également utiles en photographie. Certains polariseurs exploitent la biréfringence de certains matériaux comme le quartz, la calcite et le spath d'Islande. Ces cristaux ont la particularité de diviser un faisceau non polarisé en deux faisceaux polarisés différemment : il existe deux angles de réfraction, d'où le terme de biréfringence. On parle alors d'un rayon ordinaire, noté o, et d'un rayon extraordinaire, noté e. Un des premiers polariseurs de ce type était le prisme de Nicol, constitué d'un cristal de calcite coupé en deux puis recollé avec du baume du Canada. Ce prisme produit une polarisation de très haute qualité et a été largement utilisé en microscopie bien qu'il ait été remplacé, dans les applications modernes, par d'autres outils comme le prisme de Glan-Thompson. Les microscopes polarisants permettent de visualiser des objets de faible contraste. Cette technique permet de différencier, dans un minéral, différents cristaux de biréfringences différentes, qui apparaîtront avec une couleur et une luminosité différente. |
 La diffractométrie de rayons X est une méthode d'analyse physico-chimique. Elle ne fonctionne que sur la matière cristallisée (minéraux, métaux, céramiques, produits organiques cristallisés), mais pas sur la matière amorphe (liquides, polymères, verres) ; toutefois, la matière amorphe diffuse les rayons X, et elle peut être partiellement cristallisée, la technique peut donc se révéler utile dans ces cas-là. Par contre, elle permet de reconnaître des produits ayant la même composition chimique brute, mais une forme de cristallisation différente, par exemple de distinguer les différentes silices (quartz, cristobalite…), les différents aciers (acier ferritique, austénite…) ou les différentes alumines (corindon/alumine α, γ, δ, θ…). Les rayons X, comme toutes les ondes électromagnétiques, provoquent un déplacement du nuage électronique par rapport au noyau dans les atomes. Ces oscillations induites provoquent une réémission d'ondes électromagnétiques de même fréquence : ce phénomène est appelé diffusion Rayleigh. La longueur d'onde des rayons X étant de l'ordre de grandeur des distances interatomiques (quelques angström), les interférences des rayons diffusés vont être alternativement constructives ou destructives. Selon la direction de l'espace, on va donc avoir un flux important de photons X, ou au contraire très faible ; ces variations selon les directions forment le phénomène de diffraction des rayons X. Ce phénomène a été découvert par Max von Laue et longuement étudié par sir William Henry Bragg et son fils sir William Lawrence Bragg.
|
 Un haut fourneau est une installation industrielle destinée à simultanément désoxyder et fondre les métaux contenus dans un minerai, par la combustion d'un combustible solide riche en carbone. En général, le haut fourneau transforme du minerai de fer en fonte liquide, en brûlant du coke qui sert à la fois de combustible et d'agent réducteur. Bien que la fonte produite soit un matériau à part entière, cet alliage est généralement destiné à être affiné dans des aciéries. Le haut fourneau produit de la fonte en fusion, par opposition au bas fourneau, qui produit une loupe de fer solide. Il en est pourtant une évolution directe, mais il ne s'est généralisé que lorsqu'on a su valoriser la fonte produite. Ainsi, la Chine développe dès le Ier siècle l'usage du haut fourneau en même temps que la fonderie. L'Occident ne l'adopte qu'après le XIIe siècle, avec la mise au point des méthodes d'affinage de la fonte en acier naturel. C'est là qu'il évolue vers sa forme actuelle, la généralisation du coke et du préchauffage de l'air de combustion contribuant à la première révolution industrielle. Devenu un outil géant, sans que son principe fondamental ne change, le haut fourneau est maintenant un ensemble d'installations associées à un four. Malgré l'ancienneté du principe, l'ensemble reste un outil extrêmement complexe et difficile à maîtriser. Son rendement thermique et chimique exceptionnel lui a permis de survivre, jusqu'au début du XXIe siècle, aux bouleversements techniques qui ont jalonné l'histoire de la production de l'acier. Qu'il soit « cathédrale de feu » ou « estomac », le haut fourneau est aussi un symbole qui résume souvent un complexe sidérurgique. Il n'en est pourtant qu'un maillon : situé au cœur du processus de fabrication de l'acier, il doit être associé à une cokerie, une usine d'agglomération et une aciérie, usines au moins aussi complexes et coûteuses. Mais la disparition de ces usines, régulièrement annoncée au vu des progrès de l'aciérie électrique et de la réduction directe, n'est pourtant toujours pas envisagée. |
