Εξαφθοριούχο βολφράμιο
| Εξαφθοριούχο βολφράμιο | |||
|---|---|---|---|
| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Εξαφθοριούχο βολφράμιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | WF6 | ||
| Μοριακή μάζα | 297,830 amu | ||
| Αριθμός CAS | 7783-82-6 | ||
| SMILES | F[W](F)(F)(F)(F)F | ||
| InChI | 1S/6FH.W/h6*1H;/q;;;;;;+6/p-6 | ||
| PubChem CID | 522684 | ||
| Δομή | |||
| Διπολική ροπή | 0 D | ||
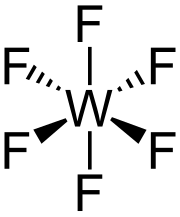
| Μοριακή γεωμετρία | Οκταεδρική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 2,3 °C | ||
| Σημείο βρασμού | 17,1 °C | ||
| Πυκνότητα | 12,4 kg/m³ 4.560 kg/m³ (υγρό στους -9 °C) | ||
| Διαλυτότητα στο νερό |
Υδρολύεται | ||
| Τάση ατμών | 113,2 kPa (20 °C) | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| Σημείο αυτανάφλεξης | Άφλεκτο | ||
| Επικινδυνότητα | |||
 
| |||
| Τοξικό (T) Διαβρωτικό (C) Δίνει υδροφθόριο με υδρόλυση | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το εξαφθοριούχο βολφράμιο είναι ανόργανη δυαδική ένωση, που περιέχει βολφράμιο και φθόριο, με μοριακό τύπο WF6. Στις κανονικές συνθήκες περιβάλλοντος, δηλαδή υπό πίεση 1 atm και σε θερμοκρασία 25 °C, είναι άχρωμο διαβρωτικό αέριο, με πυκνότητα περίπου 12,4 kg/m³, δηλαδή περί τις 11 φορές βαρύτερο από τον αέρα.[1][2][3] Το εξαφθοριούχο βολφράμιο είναι από τα βαρύτερα γνωστά αέρια υπό κανονικές συνθήκες περιβάλλοντος.[4]. Χρησιμοποιήθηκε πολύ στην παραγωγή κυκλωμάτων ημιαγωγών και πλακέτες τυπωμένου κυκλώματος, μέσω της διεργασίας της χημικής απόθεσης ατμών, δηλαδή μέσω της διάσπασης του WF6 και της απόθεσης μεταλλικού βολφραμίου. Αυτό το στρώμα βολφραμίου εξυπηρετεί ως χαμηλής αντίστασης μεταλλική ενδοσύνδεση.[5]
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το εξαφθοριούχο βολφράμιο παράγεται συνήθως με ολική σύνθεση, δηλαδή με την εξώθερμη αντίδραση μεταξύ (μεταλλικού) βολφραμίου σε μορφή σκόνης και αερίου (στοιχειακού) φθορίου, σε θερμοκρασίες 350-400 °C[6]:
Το αέριο προϊόν συμπυκνώνεται και διαχωρίζεται με απόσταξη από την κυριότερη πρόσμειξη, που είναι το οξυτετραφθοριούχο βολφράμιο (WOF4), το οποίο συμπαράγεται λόγω της παρουσίας του ατμοσφαιρικού οξυγόνου. Σε μια παραλλαγή αυτής της μεθόδου, μεταλλικό βολφράμιο τοποθετείται σε προθερμασμένο αντιδραστήρα και συμπιέζεται ελαφρά υπό πίεση 8,3 - 13,8 kPa, με την επίδραση συνεχούς ρεύματος εξαφθοριούχου βολφραμίου αναμειγμένου με μικρό ποσοστό αερίου φθορίου.[7]
Το αέριο φθόριο μπορεί να αντικατασταθεί από μονοφθοριούχο χλώριο (ClF), τριφθοριούχο χλώριο (ClF3) ή και από τριφθοριούχο βρώμιο (BrF3).
Σύμφωνα με εναλλακτικές διεργασίες, μπορεί επίσης να παραχθεί εξαφθοριούχο βολφράμιο με αντίδραση τριοξειδίου του βολφραμίου (WO3) με υδρφθόριο (HF), τριφθοριούχο βρώμιο ή τετραφθοροπυρίτιο (SiF4). Ομοίως, εξαφθοριούχο βολφράμιο επίσης μπορεί να ληφθεί και με μετατροπή εξαχλωριούχου βολφραμίου (WCl6):[8]
Δομή και ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Υπό κανονική πίεση και σε θερμοκρασίες πάνω από 17 °C, το εξαφθοριούχο βολφράμιο είναι άχρωμο[4] διαμαγνητικό αέριο. Το μόριο του εξαφθοριούχου βολφραμίου είναι οκτεδρικό, με ομάδα συμμετρίας σημείων Oh. Οι δεσμοί W-F έχουν μήκος 183,2 pm.[9] Σε θερμοκρασίες 2,3-17 °C το εξαφθοριούχο βολφράμιο είναι ανοικτοκίτρινο υγρό με πυκνότητα 3.440 kg/m³ στους 15 °C. Στους 2,3 °C πήζει σχηματίζοντας λευκό στερεό με κυβική κρυσταλλική δομή, με σταθερές πλέγματος a = 960,3 pm, b = 871,3 pm και c = 504,4 pm και πυκνότητα 4.560 kg/m³. Σε αυτήν (τη στερεή) φάση τα μοριακά μήκη δεσμών W-F είναι 181 pm, ενώ η μέση διαμοριακή απόσταση των κοντινότερων μορίων είναι 312 pm. Ως αέριο, το εξαφθοριούχο βολφράμιο είναι από τα βαρύτερα αέρια που έχουν ανακαλυφθεί, συγκρίνοντας μάλιστα την πυκνότητα 12,4 kg/m³ (που έχει στις κανονικές συνθήκες περιβάλλοντος) με την αντίστοιχη πυκνότητα του ραδονίου 9,73 kg/m³, που είναι το βαρύτερο στοιχειακό αέριο. Ως υγρό ή στερεό, το εξαφθοριούχο βολφράμιο έχει μάλλον μέτρια πυκνότητα.[10] Η τάση ατμών μεταξύ -70 και 17 °C μπορεί να υπολογιστεί από την ακόλουθη σχέση:
όπου P : η πίεση σε bar και T: η θερμοκρασία σε °C.[11][12]
Αντιδράσεις
[Επεξεργασία | επεξεργασία κώδικα]Με την επαφή του με το νερό, το εξαφθοριούχο βολφράμιο δίνει (αρχικά) υδροφθόριο και οξυφθρορίδια του βολφραμίου, που τελικά σχηματίζουν τριοξείδιο του βολφραμίου:[4]
Αντίθετα με κάποια άλλα φθορίδια μετάλλων, το εξαφθοριούχο βολφράμιο δεν είναι χρήσιμο φθοριωτικό μέσο, ούτε ισχυρό οξειδωτικό, αλλά μπορεί να αναχθεί σε κίτρινο τετραφθοριούχο βολφράμιο (WF4).[13]
Εφαρμογές στη βιομηχανία ημιαγωγών
[Επεξεργασία | επεξεργασία κώδικα]Η κυρίαρχη εφαρμογή του εξαφθοριούχου βολφραμίου είναι στη βιομηχανία ημιαγωγών, όπου χρησιμοποιήθηκε ευρύτατα για την απόθεση μεταλλικού βολφραμίου με τη διεργασία χημικής απόθεσης ατμών. Η επέκταση στη βιομηχανία κατά τις δεκαετίες '80 και '90 κατέληξε στην αύξηση της κατανάλωσης εξαφθοριούχου βολφραμίου, που παραμένει περί τους 200 τόνους ετησίως σε παγκόσμια κλίμακα. Το βολφράμιο ως μέταλλο είναι ελκυστικό εξαιτίας της σχετικά υψηλής θερμικής και χημικής σταθερότητάς του, αλλά και εξαιτίας της σχετικά μικρής αντιστασιμότητας (5.6 µΩ·cm) και ηλεκτρομετανάστευσης. Το εξαφθοριούχο βολφράμιο είναι προτιμιταίο σε σύγκριση με άλλες συγγενικές ενώσεις, όπως το εξαχλωριούχο βολφράμιο (WCl6) ή το εξαβρωμιούχο βολφράμιο (WBr6), εξαιτίας της υψηλότερης τάσης ατμών, που συνεπάγεται υψηλότερους ρυθμούς απόθεσης. Από το 1967, έχουν αναπτυχθεί και εφαρμοστεί δυο μέθοδοι απόθεσης μεταλλικού βολφραμίου από εξαφθοριούχο βολφράμιο: Η θερμική αποσύνθεση και η αναγωγή με υδρογόνο.[14] Η απαιτούμενη καθαρότητα του αερίου εξαφθοριούχου βολοφραμίου ποικίλλει μεταξύ 99,98 και 99,9995%, ανάλογα με την εφαρμογή.[4]
Παραπομπές
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Roucan, J.-P.· Noël-Dutriaux, M.-C. Proprietes Physiques des Composes Mineraux. Ed. Techniques Ingénieur. σελ. 138.
- ↑ Gas chart
- ↑ «Tungsten Hexafluoride MSDS» (pdf).[νεκρός σύνδεσμος]
- ↑ 4,0 4,1 4,2 4,3 Lassner, E.· Schubert, W.-D. (1999). Tungsten - Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. Springer. σελίδες 111, 168. ISBN 0-306-45053-4.
- ↑ Tungsten and Tungsten Silicide Chemical Vapor Deposition - CVD Fundamentals -TimeDomain CVD
- ↑ US patent 6544889, "Method for tungsten chemical vapor deposition on a semiconductor substrate", issued 2003-04-08
- ↑ US patent 6544889, "Method for tungsten chemical vapor deposition on a semiconductor substrate", issued 2003-04-08
- ↑ Lassner, E.· Schubert, W.-D. (1999). Tungsten - Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds. Springer. σελίδες 111, 168. ISBN 0-306-45053-4.
- ↑ Πρότυπο:RubberBible86th p. 4-93.
- ↑ Levy, J. (1975). «The structures of fluorides XIII: The orthorhombic form of tungsten hexafluoride at 193 K by neutron diffraction». Journal of Solid State Chemistry 15 (4): 360–365. doi:.
- ↑ Cady, G.H.; Hargreaves, G.B, “Vapour Pressures of Some Fluorides And Oxyfluorides of Molybdenum, Tungsten, Rhenium, and Osmium,” Journal of the Chemical Society, APR 1961, pp. 1568-& DOI: 10.1039/jr9610001568
- ↑ http://webbook.nist.gov/cgi/cbook.cgi?ID=C7783826&Mask=4&Type=ANTOINE&Plot=on
- ↑ Greenwood, N.N.· Earnshaw, A. (1997). Chemistry of the Elements (2nd έκδοση). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R.; Cuer, J.-P. (2005). «Fluorine Compounds, Inorganic». Στο: Ullmann, επιμ. Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.