мӮ°м„ұмқҳ
Acid| мӮ°кіј м—јкё° |
|---|
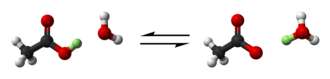 |
| мӮ° нғҖмһ… |
| лІ мқҙмҠӨ нғҖмһ… |
мӮ°мқҖ м–‘м„ұмһҗ(мҰү, мҲҳмҶҢ мқҙмҳЁ, H+)лҘј кё°мҰқн• мҲҳ мһҲлҠ” 분мһҗ лҳҗлҠ” мқҙмҳЁмңјлЎң, лёҢлўҙмҠӨн…Ңл“ң(BrГ¶nsted)лЎң м•Ңл Өм ё мһҲлӢӨ.лЎңмҡ°лҰ¬мӮ° лҳҗлҠ” лЈЁмқҙмҠӨмӮ°мңјлЎң [1]м•Ңл Ө진 м „мһҗ мҢҚкіј кіөмң кІ°н•©мқ„ нҳ•м„ұн•©лӢҲлӢӨ.
мӮ°мқҳ мІ« лІҲм§ё лІ”мЈјлҠ” м–‘м„ұмһҗ кіөм—¬мІҙ, мҰү BrГ¶nsted-мқҙлӢӨ.м Җм§ҖмӮ°.мҲҳмҡ©м•Ўмқҳ нҠ№лі„н•ң кІҪмҡ°, м–‘м„ұмһҗ кіөм—¬мһҗлҠ” н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁ3+ HOлҘј нҳ•м„ұн•ҳкі м•„л ҲлӢҲмҡ°мҠӨмӮ°мңјлЎң м•Ңл Өм ё мһҲлӢӨ.BrГ¶nstedмҷҖ LowryлҠ” 비мҲҳм„ұ мҡ©м ңлҘј нҸ¬н•Ён•ҳлҸ„лЎқ Arrenius мқҙлЎ мқ„ мқјл°ҳнҷ”н–ҲлӢӨ.BrГ¶nsted лҳҗлҠ” Arrhenius мӮ°мқҖ мқјл°ҳм ҒмңјлЎң H мҶҗмӢӨ нӣ„м—җлҸ„ м—¬м „нһҲ м—җл„Ҳм§Җм ҒмңјлЎң+ мң лҰ¬н•ң нҷ”н•ҷ кө¬мЎ°м—җ кІ°н•©лҗң мҲҳмҶҢ мӣҗмһҗлҘј нҸ¬н•Ён•ңлӢӨ.
мҲҳм„ұ м•„л ҲлӢҲмҡ°мҠӨмӮ°мқҖ [2]мӮ°мқ„ мӢӨм§Ҳм ҒмңјлЎң л¬ҳмӮ¬н•ҳлҠ” нҠ№м„ұмқ„ к°Җм§Җкі мһҲлӢӨ.мӮ°мқҖ мӢ л§ӣмқҳ мҲҳмҡ©м•Ўмқ„ нҳ•м„ұн•ҳкі , нҢҢлһҖмғү лҰ¬нҠёл¬ҙмҠӨлҘј л№Ёк°„мғүмңјлЎң л°”кҝҖ мҲҳ мһҲмңјл©°, м—јкё°мҷҖ нҠ№м • кёҲмҶҚкіј л°ҳмқ‘н•ҳм—¬ мҶҢкёҲмқ„ нҳ•м„ұн•©лӢҲлӢӨ.acidлқјлҠ” лӢЁм–ҙлҠ” 'мҡ°лҰ¬ кІғ'[3]мқ„ лң»н•ҳлҠ” лқјнӢҙм–ҙ acidus/ac,reм—җм„ң мң лһҳн–ҲлӢӨ.мӮ°мқҳ мҲҳмҡ©м•ЎмқҖ pHк°Җ 8ліҙлӢӨ мһ‘мңјл©°, кө¬м–ҙмІҙлЎң "мӮ°"мқҙлқјкі лҸ„ н•ҳм§Җл§Ң("мӮ°м—җ мҡ©н•ҙ"м—җм„ңмҷҖ к°ҷмқҙ) м—„кІ©н•ң м •мқҳлҠ” [1]мҡ©м§Ҳл§Ңмқ„ м§Җм№ӯн•ңлӢӨ.pHк°Җ лӮ®мқ„мҲҳлЎқ мӮ°лҸ„к°Җ лҶ’м•„м ё мҡ©м•Ў мӨ‘ м–‘мқҳ мҲҳмҶҢмқҙмҳЁ лҶҚлҸ„к°Җ лҶ’아진лӢӨ.мӮ°мқҳ м„ұм§Ҳмқ„ к°Җ진 м•Ҫн’Ҳ лҳҗлҠ” л¬јм§Ҳмқ„ мӮ°м„ұмқҙлқјкі н•ңлӢӨ.
мқјл°ҳм Ғмқё мҲҳмҡ©мӮ°м—җлҠ” м—јмӮ°(мң„мқҳ мң„мӮ°м—җм„ң л°ңкІ¬лҗҳм–ҙ мҶҢнҷ” нҡЁмҶҢлҘј нҷңм„ұнҷ”мӢңнӮӨлҠ” м—јнҷ”мҲҳмҶҢ мҡ©м•Ў), м•„м„ёнҠёмӮ°(мӢқмҙҲлҠ” мқҙ м•ЎмІҙмқҳ нқ¬м„қ мҲҳмҡ©м•Ў), нҷ©мӮ°(мһҗлҸҷм°Ё л°°н„°лҰ¬м—җ мӮ¬мҡ©), кө¬м—°мӮ°(к°җк·ӨлҘҳ м—ҙл§Өм—җ мӮ¬мҡ©лҗЁ) л“ұмқҙ мһҲмҠөлӢҲлӢӨ.мқҙлҹ¬н•ң мҳҲм—җм„ң м•Ң мҲҳ мһҲл“Ҝмқҙ, мӮ°мқҖ мҡ©м•Ў лҳҗлҠ” мҲңмҲҳн•ң л¬јм§Ҳмқј мҲҳ мһҲмңјл©°, м—„кІ©н•ң мқҳлҜём—җм„ң[1] мӮ°(кі нҳ•л¬ј, м•ЎмІҙ лҳҗлҠ” кё°мІҙ)м—җм„ң нҢҢмғқлҗ мҲҳ мһҲмҠөлӢҲлӢӨ.к°•н•ң мӮ°кіј мқјл¶Җ лҶҚ축лҗң м•Ҫн•ң мӮ°мқҖ л¶ҖмӢқм„ұмқҙ мһҲм§Җл§Ң, м№ҙлҘҙліҙлһҖкіј 붕мӮ°кіј к°ҷмқҖ мҳҲмҷёлҠ” мһҲмҠөлӢҲлӢӨ.
мӮ°мқҳ л‘җ лІҲм§ё лІ”мЈјлҠ” м „мһҗ мҢҚкіј кіөмң кІ°н•©мқ„ нҳ•м„ұн•ҳлҠ” лЈЁмқҙмҠӨмӮ°мһ…лӢҲлӢӨ.мҳҲлҘј л“Өм–ҙ мӮјл¶Ҳнҷ”붕мҶҢ(BF)лҠ”3 붕мҶҢ мӣҗмһҗк°Җ мҳҲлҘј л“Өм–ҙ м•”лӘЁлӢҲм•„(NH3) лӮҙмқҳ м§ҲмҶҢ мӣҗмһҗ мӨ‘ мӣҗмһҗ мң„м—җ мҷёнҶЁмқҙ м „мһҗмҢҚмқ„ кіөмң н•ЁмңјлЎңмҚЁ кіөмң кІ°н•©мқ„ нҳ•м„ұн• мҲҳ мһҲлҠ” л№Ҳ мҳӨ비нғҲмқ„ к°Җм§Җкі мһҲлҠ” 붕мҶҢ мӣҗмһҗк°Җ мһҲлӢӨ.LewisлҠ” мқҙкІғмқ„ BrГ¶nsted м •мқҳмқҳ мқјл°ҳнҷ”лЎң к°„мЈјн–ҲлӢӨ. л”°лқјм„ң мӮ°мқҖ м§Ғм ‘ лҳҗлҠ” мҡ©м•Ўм—җ м–‘м„ұмһҗ(H+)лҘј л°©м¶ңн•ҳм—¬ м „мһҗ мҢҚмқ„ мҲҳмҡ©н•ҳлҠ” нҷ”н•ҷ мў…мқҙлӢӨ.м—јнҷ”мҲҳмҶҢ, м•„м„ёнҠёмӮ° л°Ҹ кё°нғҖ лҢҖл¶Җ분мқҳ BrГ¶nsted-к·ёлҹ¬лӮҳ лЎңмҡ°лҰ¬мӮ°мқҖ м „мһҗмҢҚкіј кіөмң кІ°н•©мқ„ нҳ•м„ұн• мҲҳ м—ҶмңјлҜҖлЎң лЈЁмқҙмҠӨмӮ°мқҙ [4]м•„лӢҲлӢӨ.л°ҳлҢҖлЎң, л§ҺмқҖ лЈЁмқҙмҠӨмӮ°мқҖ Arrhenius лҳҗлҠ” BrГ¶nstedк°Җ м•„лӢҲлӢӨ.м Җм§ҖмӮ°.нҳ„лҢҖ мҡ©м–ҙм—җм„ң мӮ°мқҖ м•”л¬өм ҒмңјлЎң лёҢлўҙмҠӨн…Ңл“ңмӮ°мқҙм§Җ лЈЁмқҙмҠӨмӮ°мқҙ м•„лӢҲлӢӨ. мҷңлғҗн•ҳл©ҙ нҷ”н•ҷмһҗл“ӨмқҖ кұ°мқҳ н•ӯмғҒ [4]лЈЁмқҙмҠӨмӮ°мқ„ лЈЁмқҙмҠӨмӮ°мңјлЎң лӘ…мӢңм ҒмңјлЎң л¶ҖлҘҙкё° л•Ңл¬ёмқҙлӢӨ.
м •мқҳ л°Ҹ к°ңл…җ
нҳ„лҢҖм Ғ м •мқҳлҠ” лӘЁл“ мӮ°м—җ кіөнҶөлҗҳлҠ” к·јліём Ғмқё нҷ”н•ҷ л°ҳмқ‘м—җ кҙҖл Ёлҗҳм–ҙ мһҲмҠөлӢҲлӢӨ.
мқјмғҒмғқнҷңм—җм„ң м ‘н•ҳлҠ” лҢҖл¶Җ분мқҳ мӮ°мқҖ мҲҳмҡ©м•Ўмқҙкұ°лӮҳ л¬јм—җ л…№мқ„ мҲҳ мһҲкё° л•Ңл¬ём—җ ArrheniusмҷҖ BrГ¶nstedлҠ” лӢӨмқҢкіј к°ҷлӢӨ.Lowry м •мқҳк°Җ к°ҖмһҘ м Ғм Ҳн•©лӢҲлӢӨ.
лёҢлўҙмҠӨн…Ңл“ң-лЎңмҡ°лҰ¬ м •мқҳлҠ” к°ҖмһҘ л„җлҰ¬ мӮ¬мҡ©лҗҳлҠ” м •мқҳмқҙлӢӨ. лӢ¬лҰ¬ лӘ…мӢңлҗҳм§Җ м•ҠлҠ” н•ң мӮ°-м—јкё° л°ҳмқ‘мқҖ мӮ°м—җм„ң м—јкё°лЎңмқҳ м–‘м„ұмһҗ(H+) м „лӢ¬мқ„ мҲҳл°ҳн•ңлӢӨкі к°Җм •н•ңлӢӨ.
н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁмқҖ м„ё к°Җм§Җ м •мқҳм—җ л”°лҘё мӮ°мқҙлӢӨ.м•ҢмҪ”мҳ¬кіј м•„лҜјмқҖ лёҢлўҙмҠӨн…Ңл“ң(BrГ¶nsted)мқј мҲҳ мһҲм§Җл§Ң,лЎңмҡ°лҰ¬мӮ°мқҖ мӮ°мҶҢмҷҖ м§ҲмҶҢ мӣҗмһҗм—җ мһҲлҠ” м „мһҗмқҳ мҷёлЎңмҡҙ мҢҚ л•Ңл¬ём—җ лЈЁмқҙмҠӨ м—јкё°лЎңлҸ„ кё°лҠҘн• мҲҳ мһҲмҠөлӢҲлӢӨ.
м•„л ҲлӢҲмҡ°мҠӨмӮ°
1884л…„, мҠӨл°ҳн…Ң м•„л ҲлӢҲмҡ°мҠӨлҠ” мӮ°м„ұмқҳ нҠ№м„ұмқ„ лӮҳмӨ‘м—җ м–‘м„ұмһҗ лҳҗлҠ” н•ҳмқҙл“ңлЎ мқҙлқјкі кё°мҲ лҗҳлҠ” мҲҳмҶҢ мқҙмҳЁ(H+)мқҳ нғ“мңјлЎң лҸҢл ёлӢӨ.м•„л ҲлӢҲмҡ°мҠӨмӮ°мқҖ л¬јм—җ мІЁк°Җн•ҳл©ҙ [4][5]л¬ј мҶҚмқҳ HмқҙмҳЁ лҶҚлҸ„к°Җ+ лҶ’м•„м§ҖлҠ” л¬јм§ҲмқҙлӢӨ.нҷ”н•ҷмһҗлҠ” мӮ°м—јкё° л°ҳмқ‘мқ„ м„ӨлӘ…н• л•Ң мў…мў… H(aq)лҘј+ м“°кі мҲҳмҶҢ мқҙмҳЁмқ„ м–ёкёүн•ҳм§Җл§Ң мң лҰ¬ мҲҳмҶҢ н•өмқё м–‘м„ұмһҗлҠ” л¬ј мҶҚм—җ лӢЁлҸ…мңјлЎң мЎҙмһ¬н•ҳлҠ” кІғмқҙ м•„лӢҲлқј н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁ(HO3+, HO94+) лҳҗлҠ” лӢӨлҘё нҳ•нғң(HO52+)лЎң мЎҙмһ¬н•ңлӢӨ.л”°лқјм„ң м•„л ҲлӢҲмҡ°мҠӨмӮ°мқҖ л¬јм—җ мІЁк°Җн•ҳл©ҙ н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁмқҳ лҶҚлҸ„лҘј лҶ’мқҙлҠ” л¬јм§Ҳмқҙлқјкі лҸ„ н• мҲҳ мһҲлӢӨ.мҳҲлҘј л“Өм–ҙ м—јнҷ”мҲҳмҶҢлӮҳ м•„м„ёнҠёмӮ°кіј к°ҷмқҖ 분мһҗ л¬јм§Ҳмқ„ л“Ө мҲҳ мһҲлӢӨ.
л°ҳл©ҙ м•„л ҲлӢҲмҡ°мҠӨ м—јкё°лҠ” л¬јм—җ л…№мңјл©ҙ мҲҳмӮ°нҷ”л¬ј(OHвҲ’) мқҙмҳЁмқҳ лҶҚлҸ„к°Җ лҶ’м•„м§ҖлҠ” л¬јм§ҲмқҙлӢӨ.мқҙмҳЁмқҙ л°ҳмқ‘н•ҳм—¬ HO 분мһҗлҘј нҳ•м„ұн•ҳкё°2 л•Ңл¬ём—җ мқҙлҠ” н•ҳмқҙл“ңлЎңлҠ„мқҳ лҶҚлҸ„лҘј лӮ®мҠөлӢҲлӢӨ.
- HO3+
(aq)вҲ’
(aq) + OH ho2(liq) HO + HO2(liq)
мқҙ нҸүнҳ• л•Ңл¬ём—җ н•ҳмқҙл“ңлЎңлҠ„мқҳ лҶҚлҸ„к°Җ мҰқк°Җн•ҳл©ҙ мҲҳмӮ°нҷ”л¬јмқҳ лҶҚлҸ„к°Җ к°җмҶҢн•ңлӢӨ.л”°лқјм„ң, м•„л ҲлӢҲмҡ°мҠӨмӮ°мқҖ мҲҳмӮ°нҷ”л¬ј лҶҚлҸ„лҘј к°җмҶҢмӢңнӮӨлҠ” л°ҳл©ҙ м•„л ҲлӢҲмҡ°мҠӨ м—јкё°лҠ” мҲҳмӮ°нҷ”л¬ј лҶҚлҸ„лҘј мҰқк°ҖмӢңнӮӨлҠ” мӮ°мқҙлқјкі лҸ„ н• мҲҳ мһҲлӢӨ.
мӮ°м„ұмҡ©м•Ў мӨ‘ н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁ лҶҚлҸ„лҠ” лҰ¬н„°лӢ№ 10лӘ° мқҙмғҒмқҙлӢӨвҲ’7.pHлҠ” н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁ лҶҚлҸ„мқҳ мқҢлҢҖмҲҳлЎң м •мқҳлҗҳкё° л•Ңл¬ём—җ мӮ°м„ұмҡ©м•ЎмқҖ pHк°Җ 7 лҜёл§ҢмқҙлӢӨ.
лёҢлўҙмҠӨн…Ңл“ң-лЎңмҡ°лҰ¬мӮ°

м•„л ҲлӢҲмҡ°мҠӨ к°ңл…җмқҖ л§ҺмқҖ л°ҳмқ‘мқ„ кё°мҲ н•ҳлҠ” лҚ° мң мҡ©н•ҳм§Җл§Ң, к·ё лІ”мң„ лҳҗн•ң мғҒлӢ№нһҲ м ңн•ңм ҒмқҙлӢӨ.1923л…„ нҷ”н•ҷмһҗ мҡ”н•ҳл„ӨмҠӨ лӢҲмҪңлқјмҡ°мҠӨ лёҢлўҙмҠӨн…Ңл“ңмҷҖ нҶ л§ҲмҠӨ л§ҲнӢҙ лЎңлҰ¬лҠ” мӮ°м—јкё° л°ҳмқ‘мқҙ м–‘м„ұмһҗмқҳ м „лӢ¬мқ„ мҲҳл°ҳн•ңлӢӨлҠ” кІғмқ„ лҸ…лҰҪм ҒмңјлЎң мқём •н–ҲлӢӨ.A лёҢлўҙмҠӨн…Ңл“ң-лЎңмҡ°лҰ¬мӮ°(лҳҗлҠ” лӢЁмҲңнһҲ лёҢлўҙмҠӨн…Ңл“ңмӮ°)мқҖ лёҢлўҙмҠӨн…Ңл“ңм—җкІҢ м–‘м„ұмһҗлҘј кё°мҰқн•ҳлҠ” мў…мқҙлӢӨ.лЎңмҡ°лҰ¬ кё°м§Җ.[5]лёҢлўҙмҠӨн…Ңл“ң-лЎңмҡ°лҰ¬мӮ°м—јкё°мқҙлЎ мқҖ м•„л ҲлӢҲмҡ°мҠӨмқҙлЎ м—җ 비н•ҙ лӘҮ к°Җм§Җ мқҙм җмқҙ мһҲлӢӨ.мӢқмҙҲмқҳ лҸ…нҠ№н•ң л§ӣмқ„ лӮҙлҠ” мң кё°мӮ°мқё м•„м„ёнҠёмӮ°(CHCOOH3)мқҳ лӢӨмқҢкіј к°ҷмқҖ л°ҳмқ‘мқ„ кі л Өн•ҙ ліҙмӢӯмӢңмҳӨ.
- CHCOOH3 + HO2 ch3вҲ’ CHCOO + HO3+
- CHCOOH3 + NH3 ch3вҲ’ CHCOO + NH+4
л‘җ3 мқҙлЎ лӘЁл‘җ мІ« лІҲм§ё л°ҳмқ‘мқ„ мүҪкІҢ л¬ҳмӮ¬н•ңлӢӨ: CHCOOHлҠ” л¬јм—җ л…№м•ҳмқ„ л•Ң HOмқҳ кіөкёүмӣҗмңјлЎң3+ мһ‘мҡ©н•ҳкё° л•Ңл¬ём—җ м•„л ҲлӢҲмҡ°мҠӨмӮ°мңјлЎң мһ‘мҡ©н•ҳкі , л¬јм—җ м–‘м„ұмһҗлҘј кё°мҰқн•ЁмңјлЎңмҚЁ лёҢлўҙмҠӨн…Ңл“ңмӮ°мңјлЎң мһ‘мҡ©н•ңлӢӨ.л‘җ лІҲм§ё мҳҲм—җм„ң3 CHCOOHлҠ” лҸҷмқјн•ң ліҖнҷҳмқ„ кұ°м№ҳм§Җл§Ң3, мқҙ кІҪмҡ° м•”лӘЁлӢҲм•„(NH)м—җ м–‘м„ұмһҗлҘј кё°мҰқн•ҳм§Җл§Ң, л°ҳмқ‘мқҙ н•ҳмқҙл“ңлЎңлҠ„мқ„ мғқм„ұн•ҳм§Җ м•Ҡкё° л•Ңл¬ём—җ мӮ°мқҳ м•„л ҲлӢҲмҡ°мҠӨ м •мқҳмҷҖлҠ” кҙҖл Ёмқҙ м—ҶлӢӨ.к·ёлҹјм—җлҸ„3 л¶Ҳкө¬н•ҳкі CHCOOHлҠ” Arreniusмқҙл©ҙм„ң BrГ¶nstedмқҙлӢӨ.лЎңлҰ¬мӮ°.
лёҢлўҙмҠӨн…Ңл“ң-лЎңмҡ°лҰ¬ мқҙлЎ мқҖ 비мҲҳ мҡ©м•Ў лҳҗлҠ” кё°мІҙмғҒм—җм„ңмқҳ 분мһҗ нҷ”н•©л¬јмқҳ л°ҳмқ‘мқ„ м„ӨлӘ…н•ҳкё° мң„н•ҙ мӮ¬мҡ©лҗ мҲҳ мһҲлӢӨ.м—јнҷ”мҲҳмҶҢ(HCl)мҷҖ м•”лӘЁлӢҲм•„лҠ” лӘҮ к°Җм§Җ лӢӨлҘё мЎ°кұҙм—җм„ң кІ°н•©н•ҳм—¬ м—јнҷ”м•”лӘЁлҠ„, NHClмқ„4 нҳ•м„ұн•©лӢҲлӢӨ.мҲҳмҡ©м•Ўм—җм„ң HClмқҖ м—јмӮ°мңјлЎң мһ‘мҡ©н•ҳл©° н•ҳмқҙл“ңлЎңлҠ„кіј м—јнҷ”л¬ј мқҙмҳЁмңјлЎң мЎҙмһ¬н•ңлӢӨ.лӢӨмқҢ л°ҳмқ‘мқҖ м•„л ҲлӢҲмҡ°мҠӨ м •мқҳмқҳ н•ңкі„лҘј ліҙм—¬мӨҖлӢӨ.
- HO3+
(aq) + ClвҲ’
(aq) + NH3 вҶ’ ClвҲ’
(aq) + NH+
4(aq)2 + HO - HCl(benzene) + NH3(benzene) вҶ’ NHCl4(s)
- HCl(g) + NH3(g) вҶ’ NHCl4(s)
м•„м„ёнҠёмӮ° л°ҳмқ‘кіј л§Ҳм°¬к°Җм§ҖлЎң мІ« лІҲм§ё мҳҲм—җм„ңлҠ” л‘җ к°Җм§Җ м •мқҳк°Җ лӘЁл‘җ мһ‘мҡ©н•©лӢҲлӢӨ. м—¬кё°м„ң л¬јмқҖ мҡ©л§Өмқҙкі н•ҳмқҙл“ңлЎңлҠ„ мқҙмҳЁмқҖ HCl мҡ©л§Өм—җ мқҳн•ҙ нҳ•м„ұлҗ©лӢҲлӢӨ.лӢӨмқҢ л‘җ к°Җм§Җ л°ҳмқ‘мқҖ мқҙмҳЁ нҳ•м„ұкіј кҙҖл Ёмқҙ м—Ҷм§Җл§Ң м—¬м „нһҲ м–‘м„ұмһҗ м „лӢ¬ л°ҳмқ‘мқҙлӢӨ.л‘җ лІҲм§ё л°ҳмқ‘м—җм„ңлҠ” м—јнҷ”мҲҳмҶҢмҷҖ м•”лӘЁлӢҲм•„(лІӨм м—җ мҡ©н•ҙлҗЁ)к°Җ л°ҳмқ‘н•ҳм—¬ лІӨм мҡ©л§Ө лӮҙм—җм„ң кі мІҙ м—јнҷ”м•”лӘЁлҠ„мқ„ нҳ•м„ұн•ҳкі , м„ё лІҲм§ё к°ҖмҠӨм—җм„ңлҠ” HClкіј3 NHк°Җ кІ°н•©н•ҳм—¬ кі мІҙлҘј нҳ•м„ұн•ңлӢӨ.
лЈЁмқҙмҠӨмӮ°
м„ё лІҲм§ё, м•„мЈј м•Ҫк°„л§Ң кҙҖл Ёмқҙ мһҲлҠ” к°ңл…җмқҖ 1923л…„ кёёлІ„нҠё Nм—җ мқҳн•ҙ м ңм•Ҳлҗҳм—ҲлӢӨ. лЈЁмқҙмҠӨ: м–‘м„ұмһҗ м „лӢ¬мқ„ мҲҳл°ҳн•ҳм§Җ м•ҠлҠ” мӮ°м—јкё° нҠ№м„ұкіјмқҳ л°ҳмқ‘мқ„ нҸ¬н•Ён•ңлӢӨ.лЈЁмқҙмҠӨмӮ°мқҖ лӢӨлҘё мў…мңјлЎңл¶Җн„° н•ң мҢҚмқҳ м „мһҗлҘј л°ӣм•„л“ӨмқҙлҠ” мў…мқҙлӢӨ. мҰү, м „мһҗмҢҚ мҲҳмҡ©мІҙмқҙлӢӨ.[5]лёҢлўҙмҠӨн…Ңл“ңмӮ°м—јкё° л°ҳмқ‘мқҖ м–‘м„ұмһҗ м „лӢ¬ л°ҳмқ‘мқҙкі лЈЁмқҙмҠӨмӮ°м—јкё° л°ҳмқ‘мқҖ м „мһҗмҢҚ м „лӢ¬ л°ҳмқ‘мқҙлӢӨ.л§ҺмқҖ лЈЁмқҙмҠӨмӮ°мқҖ лёҢлўҙмҠӨн…Ңл“ңк°Җ м•„лӢҲлӢӨ.м Җм§ҖмӮ°.мӮ°-м—јкё° нҷ”н•ҷмқҳ кҙҖм җм—җм„ң лӢӨмқҢкіј к°ҷмқҖ л°ҳмқ‘мқҙ м–ҙл–»кІҢ м„ӨлӘ…лҗҳлҠ”м§ҖлҘј лҢҖмЎ°н•ңлӢӨ.
мІ« лІҲм§ё л°ҳмқ‘м—җм„ң л¶Ҳнҷ”л¬ј мқҙмҳЁ FлҠ”вҲ’ м „мһҗмҢҚмқ„ мӮјл¶Ҳнҷ”붕мҶҢм—җ нҸ¬кё°н•ҳкі 4л¶Ҳнҷ”붕мҶҢ мғқм„ұл¬јмқ„ нҳ•м„ұн•ңлӢӨ.н”ҢлЈЁмҳӨлҘҙнҷ”л¬јмқҖ B-F кІ°н•©м—җм„ң кіөмң лҗҳлҠ” м „мһҗк°Җ л‘җ мӣҗмһҗн•ө мӮ¬мқҙмқҳ кіөк°„м—җ мң„м№ҳн•ҳкё° л•Ңл¬ём—җ лӢЁмқј н”ҢлЈЁмҳӨлҘҙнҷ”л¬ј мқҙмҳЁм—җ мһҲлҠ” кІғліҙлӢӨ н”ҢлЈЁмҳӨлҘҙнҷ”л¬ј н•өм—җм„ң лҚ” л©ҖлҰ¬ л–Ём–ҙм ё мһҲкё° л•Ңл¬ём—җ н•ң мҢҚмқҳ мӣҗмһҗк°Җ м „мһҗлҘј "мҶҢмӢӨ"мӢңнӮЁлӢӨ.BFлҠ”3 л¶Ҳнҷ”л¬јлЎңл¶Җн„° м „мһҗмҢҚмқ„ л°ӣм•„л“Өмқҙкё° л•Ңл¬ём—җ лЈЁмқҙмҠӨмӮ°мқҙлӢӨ.мқҙ л°ҳмқ‘мқҖ м–‘м„ұмһҗ мқҙлҸҷмқҙ м—Ҷкё° л•Ңл¬ём—җ лёҢлўҙмҠӨн…Ңл“ң мқҙлЎ мңјлЎң м„ӨлӘ…н• мҲҳ м—ҶлӢӨ.л‘җ лІҲм§ё л°ҳмқ‘мқҖ л‘җ к°Җм§Җ мқҙлЎ мӨ‘ н•ҳлӮҳлҘј мӮ¬мҡ©н•ҳм—¬ м„ӨлӘ…н• мҲҳ мһҲлӢӨ.м–‘м„ұмһҗлҠ” л¶ҲнҠ№м • лёҢлўҙмҠӨн…Ңл“ңмӮ°мңјлЎңл¶Җн„° лёҢлўҙмҠӨн…Ңл“ңм—јкё°мқё м•”лӘЁлӢҲм•„лЎң мқҙн–үлҗңлӢӨ.лҳҗн•ң м•”лӘЁлӢҲм•„лҠ” лЈЁмқҙмҠӨм—јкё°лЎң мһ‘мҡ©н•ҳл©° мҲҳмҶҢмқҙмҳЁкіјмқҳ кІ°н•©мқ„ нҳ•м„ұн•ҳкё° мң„н•ҙ н•ҳлӮҳмқҳ м „мһҗмҢҚмқ„ мқҙн–үн•ңлӢӨ.м „мһҗмҢҚмқ„ м–»лҠ” мў…мқҖ лЈЁмқҙмҠӨмӮ°мқҙлӢӨ; мҳҲлҘј л“Өм–ҙ, H-O кІ°н•© мӨ‘ н•ҳлӮҳк°Җ лҒҠм–ҙм§Җкі кІ°н•©м—җм„ң кіөмң лҗҳлҠ” м „мһҗк°Җ мӮ°мҶҢм—җ көӯмҶҢнҷ” лҗ л•Ң HOмқҳ мӮ°мҶҢ3+ мӣҗмһҗлҠ” м „мһҗмҢҚмқ„ м–»лҠ”лӢӨ.л¬ёл§Ҙм—җ л”°лқј лЈЁмқҙмҠӨмӮ°мқҖ мӮ°нҷ”м ң лҳҗлҠ” м№ңм „мһҗм„ұ л¬јм§ҲлЎң м„ӨлӘ…лҗ мҲҳлҸ„ мһҲлӢӨ.м•„м„ёнҠёмӮ°, кө¬м—°мӮ° лҳҗлҠ” мҳҘмӮҙмӮ°кіј к°ҷмқҖ мң кё° лёҢлўҙмҠӨн…Ңл“ңмӮ°мқҖ лЈЁмқҙмҠӨмӮ°мқҙ [4]м•„лӢҲлӢӨ.к·ёкІғл“ӨмқҖ л¬јм—җм„ң 분н•ҙлҗҳм–ҙ лЈЁмқҙмҠӨмӮ°, HлҘј+ мғқм„ұн•ҳм§Җл§Ң, лҸҷмӢңм—җ лҸҷмқјн•ң м–‘мқҳ лЈЁмқҙмҠӨ м—јкё°(к°Ғк°Ғ м–ёкёүлҗң мӮ°мқҳ кІҪмҡ° м•„м„ёнҠёмӮ°, кө¬м—°мӮ° лҳҗлҠ” мҳҘмӮҙмӮ°)лҘј мғқм„ұн•ңлӢӨ.мқҙ кё°мӮ¬лҠ” лЈЁмқҙмҠӨмӮ°ліҙлӢӨлҠ” лёҢлўҙмҠӨн…Ңл“ңмӮ°мқ„ мЈјлЎң лӢӨлЈ¬лӢӨ.
н•ҙлҰ¬ л°Ҹ нҸүнҳ•
мӮ°мқҳ л°ҳмқ‘мқҖ мў…мў… HA h+ H + AвҲ’ нҳ•нғңлЎң мқјл°ҳнҷ”лҗҳлҠ”лҚ°, м—¬кё°м„ң HAлҠ” мӮ°мқ„ лӮҳнғҖлӮҙкі вҲ’ AлҠ” мјӨл Ҳ м—јкё°мқҙлӢӨ.мқҙ л°ҳмқ‘мқ„ н”„лЎңнҶЁлҰ¬мӢңмҠӨлқјкі н•ңлӢӨ.мӮ°мқҳ м–‘м„ұмһҗнҷ” нҳ•нғң(HA)лҠ” л•Ңл•ҢлЎң [6]мң лҰ¬мӮ°мқҙлқјкі лҸ„ н•ңлӢӨ.
мӮ°-м—јкё° мјӨл Ҳ мҢҚмқҖ м–‘м„ұмһҗ 1к°ңм”© лӢӨлҘҙл©° м–‘м„ұмһҗмқҳ 추к°Җ лҳҗлҠ” м ңкұ°м—җ мқҳн•ҙ мғҒнҳё ліҖнҷҳлҗ мҲҳ мһҲлӢӨ(к°Ғк°Ғ м–‘м„ұмһҗмҷҖ нғҲм–‘м„ұмһҗ).мӮ°мқҖ н•ҳм „мў…мқҙ лҗ мҲҳ мһҲкі , мјӨл Ҳ м—јкё°лҠ” мӨ‘м„ұмқј мҲҳ мһҲмңјл©°, мқҙ кІҪмҡ° мқјл°ҳнҷ”лҗң л°ҳмқ‘ л°©мӢқмқҖ HA+ + H + AлЎң+ кё°лЎқлҗ мҲҳ мһҲлӢӨ. мҡ©м•Ўм—җм„ңлҠ” мӮ°кіј мјӨл Ҳ м—јкё° мӮ¬мқҙм—җ нҸүнҳ•мқҙ мЎҙмһ¬н•ңлӢӨ.нҸүнҳ• мғҒмҲҳ KлҠ” мҡ©м•Ў мҶҚмқҳ 분мһҗ лҳҗлҠ” мқҙмҳЁмқҳ нҸүнҳ• лҶҚлҸ„мқҳ н‘ңнҳ„мқҙлӢӨ.кҙ„нҳёлҠ” [HO2]к°Җ HOмқҳ2 лҶҚлҸ„лҘј мқҳлҜён•ҳлҸ„лЎқ лҶҚлҸ„лҘј лӮҳнғҖлӮёлӢӨ.мӮ° н•ҙлҰ¬ мғҒмҲҳa KлҠ” мқјл°ҳм ҒмңјлЎң мӮ°-м—јкё° л°ҳмқ‘мқҳ л§ҘлқҪм—җм„ң мӮ¬мҡ©лҗңлӢӨ.Kмқҳ мҲҳм№ҳлҠ”a мғқм„ұл¬ј лҶҚлҸ„лҘј л°ҳмқ‘л¬ј лҶҚлҸ„лЎң лӮҳлҲҲ кіұ(кіұм…Ҳ)кіј к°ҷмңјл©°, м—¬кё°м„ң л°ҳмқ‘л¬јмқҖ мӮ°(HA), мғқм„ұл¬јмқҖ мјӨл Ҳм—јкё°, HмқҙлӢӨ+.
л‘җ мӮ° мӨ‘ к°•н•ң мӮ°мқҙ м•Ҫн•ң мӮ°ліҙлӢӨ лҶ’мқҖa KлҘј к°Җм§Җл©°, к°•н•ң мӮ°мқҙ м–‘м„ұмһҗлҘј мһғлҠ” кІҪн–Ҙмқҙ лҚ” нҒ¬кё° л•Ңл¬ём—җ к°•н•ң мӮ°м—җ лҢҖн•ң мҲҳмҶҢ мқҙмҳЁмқҳ 비мңЁмқҖ лҚ” лҶ’мҠөлӢҲлӢӨ.Kм—җ лҢҖн•ҙa к°ҖлҠҘн•ң к°’мқҳ лІ”мң„лҠ” кҙҖлҰ¬н•ҳкё° мү¬мҡҙ мғҒмҲҳмқё м—¬лҹ¬ м°ЁмҲҳм—җ кұёміҗ мһҲмңјлҜҖлЎң pKк°Җa лҚ” мһҗмЈј мӮ¬мҡ©лҗ©лӢҲлӢӨ. м—¬кё°м„ңa pK = -log10a Kмһ…лӢҲлӢӨ.к°•н•ң мӮ°мқјмҲҳлЎқ м•Ҫн•ң мӮ°ліҙлӢӨ pKк°Җa мһ‘мҠөлӢҲлӢӨ.мҲҳмҡ©м•Ў мӨ‘ 25В°Cм—җм„ң мӢӨн—ҳм ҒмңјлЎң мёЎм •лҗң pKлҠ”a көҗкіјм„ң л°Ҹ н‘ңмӨҖл¬јм§Ҳм—җ мһҗмЈј мқёмҡ©лҗңлӢӨ.
лӘ…лӘ…лІ•
м•„л ҲлӢҲмҡ°мҠӨмӮ°мқҖ мқҢмқҙмҳЁм—җ л”°лқј мқҙлҰ„мқҙ л¶ҷ여진лӢӨ.кі м „м Ғмқё лӘ…лӘ… мІҙкі„м—җм„ңлҠ” лӢӨмқҢ н‘ңм—җ л”°лқј мқҙмҳЁ м ‘лҜёмӮ¬к°Җ мӮӯм ңлҗҳкі мғҲлЎңмҡҙ м ‘лҜёмӮ¬лЎң лҢҖмІҙлҗ©лӢҲлӢӨ."hydro-"лқјлҠ” м ‘л‘җмӮ¬лҠ” мӮ°мқҙ мҲҳмҶҢмҷҖ лӢӨлҘё н•ҳлӮҳмқҳ мӣҗмҶҢлЎңл§Ң кө¬м„ұлҗҳм–ҙ мһҲмқ„ л•Ң мӮ¬мҡ©лҗ©лӢҲлӢӨ.мҳҲлҘј л“Өм–ҙ HClмқҖ мқҢмқҙмҳЁмңјлЎң м—јнҷ”л¬јмқ„ к°Җм§Җкі мһҲкё° л•Ңл¬ём—җ мҲҳмҶҢ м ‘л‘җмӮ¬лҘј мӮ¬мҡ©н•ҳл©°, -ide м ‘лҜёмӮ¬лҠ” м—јмӮ° нҳ•нғңлҘј лқӨлӢӨ.
кі м „м Ғмқё лӘ…лӘ… мІҙкі„:
| мқҢмқҙмҳЁ н”„лҰ¬н”ҪмҠӨ | мқҢмқҙмҳЁ м ‘лҜёмӮ¬ | мӮ° н”„лҰ¬н”ҪмҠӨ | мӮ°м„ңн”ҪмҠӨ | мҳҲ |
|---|---|---|---|---|
| м—җ л”°лқј | лЁ№м—ҲлӢӨ. | м—җ л”°лқј | ICмӮ° | кіјм—јмҶҢмӮ°(HClO4) |
| лЁ№м—ҲлӢӨ. | ICмӮ° | м—јмҶҢмӮ°(HClO3) | ||
| мқҙн…Ң | мҳӨмҠӨмӮ° | м—јмҶҢмӮ°(HClO2) | ||
| н•ҳмқҙнҸ¬ | мқҙн…Ң | н•ҳмқҙнҸ¬ | мҳӨмҠӨмӮ° | н•ҳмқҙнҸ¬м•„м—јмҶҢмӮ°(HClO) |
| ide | н•ҳмқҙл“ңлЎң | ICмӮ° | м—јмӮ°(HCl) |
IUPAC лӘ…лӘ… мІҙкі„м—җм„ңлҠ” мқҙмҳЁ нҷ”н•©л¬ј мқҙлҰ„м—җ "мҲҳ"к°Җ лӢЁмҲңнһҲ 추к°Җлҗ©лӢҲлӢӨ.л”°лқјм„ң м—јнҷ”мҲҳмҶҢмқҳ кІҪмҡ° мӮ°мҡ©м•ЎмңјлЎңм„ң IUPACлҠ” м—јнҷ”мҲҳмҶҢ мҲҳмҡ©м•ЎмқҙлӢӨ.
мӮ°к°•лҸ„
мӮ°мқҳ к°•лҸ„лҠ” м–‘м„ұмһҗлҘј мһғлҠ” лҠҘл ҘмқҙлӮҳ кІҪн–Ҙмқ„ л§җн•ңлӢӨ.к°•мӮ°мқҖ л¬јм—җм„ң мҷ„м „нһҲ н•ҙлҰ¬лҗҳлҠ” мӮ°мқҙлӢӨ. мҰү, к°•мӮ° HAмқҳ 1лӘ°мқҙ л¬јм—җ мҡ©н•ҙлҗҳм–ҙ Hмқҳ+ 1лӘ°кіј мјӨл Ҳ м—јкё° AмқҳвҲ’ 1лӘ°мқҙ мғқм„ұлҗҳкі м–‘м„ұмһҗнҷ” мӮ° HAлҠ” мғқм„ұлҗҳм§Җ м•ҠлҠ”лӢӨ.л°ҳл©ҙ м•ҪмӮ°мқҖ л¶Җ분м ҒмңјлЎңл§Ң н•ҙлҰ¬лҗҳл©°, нҸүнҳ•мғҒнғңм—җм„ң мӮ°кіј мјӨл Ҳм—јкё° лӘЁл‘җ мҡ©м•Ўм—җ мһҲлӢӨ.к°•мӮ°мқҳ мҳҲлЎңлҠ” м—јмӮ°(HCl), мҡ”мҳӨл“ңмӮ°(HI), лёҢлЎ¬мӮ°(HBr), кіјм—јмҶҢмӮ°(HClO4), м§ҲмӮ°(HNO3), нҷ©мӮ°(HSO24) л“ұмқҙ мһҲлӢӨ.л¬ј мҶҚм—җм„ң мқҙл“Ө к°Ғк°ҒмқҖ кё°ліём ҒмңјлЎң 100% мқҙмҳЁнҷ”лҗңлӢӨ.мӮ°мқҙ к°•н• мҲҳлЎқ м–‘м„ұмһҗ+ HлҘј мһғкё° мүҪлӢӨ.нғҲм–‘м„ұмһҗмқҳ мҡ©мқҙм„ұм—җ кё°м—¬н•ҳлҠ” 2к°Җм§Җ мЈјмҡ” мҡ”мқёмқҖ H-A кІ°н•©мқҳ к·№м„ұкіј H-A кІ°н•©мқҳ к°•лҸ„лҘј кІ°м •н•ҳлҠ” мӣҗмһҗ Aмқҳ нҒ¬кё°мһ…лӢҲлӢӨ.мӮ° к°•лҸ„лҠ” лҳҗн•ң мў…мў… мјӨл Ҳ м—јкё°мқҳ м•Ҳм •м„ұ мёЎл©ҙм—җм„ң л…јмқҳлҗңлӢӨ.
к°•н•ң мӮ°мқҖ м•Ҫн•ң мӮ°ліҙлӢӨ лҶ’мқҖ мӮ° н•ҙлҰ¬ мғҒмҲҳa KмҷҖ мқҢмқҳ pKлҘјa к°Җ집лӢҲлӢӨ.
мҲ нҸ°мӮ°мқҖ мң кё°мӮ°нҷ”л¬јм§ҲлЎң к°•н•ң мӮ°мқҳ н•ң мў…лҘҳмқҙлӢӨ.мқјл°ҳм Ғмқё мҳҲлЎңлҠ” нҶЁлЈЁм—”мҲ нҸ°мӮ°(нҶ мӢӨмӮ°)мқҙ мһҲлӢӨ.нҷ©мӮ° мһҗмІҙмҷҖ лӢ¬лҰ¬ мҲ нҸ°мӮ°мқҖ кі мІҙмқј мҲҳ мһҲлӢӨ.мӢӨм ңлЎң нҸҙлҰ¬мҠӨнӢ°л Ң мҲ нҸ°мӮ°м—јмңјлЎң кё°лҠҘн•ҳлҠ” нҸҙлҰ¬мҠӨнӢ°л ҢмқҖ м—¬кіј к°ҖлҠҘн•ң кі мІҙ к°•мӮ°м„ұ н”ҢлқјмҠӨнӢұмқҙлӢӨ.
мҙҲмӮ°мқҖ 100% нҷ©мӮ°ліҙлӢӨ к°•н•ң мӮ°мқҙлӢӨ.мҙҲмӮ°мқҳ мҳҲлЎңлҠ” н”ҢлЈЁмҳӨлЎңм•ҲнӢ°лӘ¬мӮ°, л§Өм§ҒмӮ°, кіјм—јмҶҢмӮ° л“ұмқҙ мһҲлӢӨ.мҙҲмӮ°мқҖ л¬јмқ„ мҳҒкө¬м ҒмңјлЎң м–‘м„ұмһҗлЎң л§Ңл“Өм–ҙ мқҙмҳЁм„ұ кІ°м •м„ұ н•ҳмқҙл“ңлЎңлҠ„ "м—јмҲҳ"лҘј мӨ„ мҲҳ мһҲмҠөлӢҲлӢӨ.лҳҗн•ң нғ„нҷ”мҲҳмҶҢлҸ„ м •лҹүм ҒмңјлЎң м•Ҳм •нҷ”мӢңнӮ¬ мҲҳ мһҲмҠөлӢҲлӢӨ.
KлҠ” мӮ°м„ұнҷ”н•©л¬јмқҳ к°•лҸ„лҘј мёЎм •н•ҳлҠ” л°ҳл©ҙa, мҲҳмҡ©мӮ°мҡ©м•Ўмқҳ к°•лҸ„лҠ” мҡ©м•Ў мӨ‘мқҳ н•ҳмқҙл“ңлЎңлҠ„ лҶҚлҸ„лҘј лӮҳнғҖлӮҙлҠ” pHлЎң мёЎм •н•ңлӢӨ.л¬јм—җ мһҲлҠ” мӮ°м„ұ нҷ”н•©л¬јмқҳ лӢЁмҲң мҡ©м•Ўмқҳ pHлҠ” нҷ”н•©л¬јмқҳ нқ¬м„қ л°Ҹ нҷ”н•©л¬јмқҳ Kм—җa мқҳн•ҙ кІ°м •лҗңлӢӨ.
비мҲҳмҡ©м•Ўмқҳ лЈЁмқҙмҠӨмӮ° к°•лҸ„
Lewis acidsлҠ” ECW лӘЁлҚём—җм„ң 분лҘҳлҗҳм—Ҳмңјл©° мӮ° [7]к°•лҸ„мқҳ мҲңм„ңлҠ” лӢЁ н•ң к°Җм§ҖлҸ„ м—ҶлҠ” кІғмңјлЎң лӮҳнғҖлӮ¬мҠөлӢҲлӢӨ.мқјл Ёмқҳ м—јкё°м—җ лҢҖн•ң лЈЁмқҙмҠӨ мӮ°мқҳ мғҒлҢҖ мҲҳмҡ©мІҙ к°•лҸ„лҠ” C-B [8][9]н”ҢлЎҜмңјлЎң м„ӨлӘ…н• мҲҳ мһҲлӢӨ.лЈЁмқҙмҠӨ мӮ° к°•лҸ„мқҳ мҲңм„ңлҘј м •мқҳн•ҳл Өл©ҙ м Ғм–ҙлҸ„ л‘җ к°Җм§Җ нҠ№м„ұмқ„ кі л Өн•ҙм•ј н•ңлӢӨлҠ” кІғмқҙ л°қнҳҖмЎҢлӢӨ.Pearsonмқҳ м •м„ұм Ғ HSAB мқҙлЎ мқҳ кІҪмҡ° кІҪлҸ„мҷҖ к°•лҸ„мқҳ л‘җ к°Җм§Җ нҠ№м„ұмқҙ мһҲлҠ” л°ҳл©ҙ, Dragoмқҳ м •лҹүм Ғ ECW лӘЁлҚёмқҳ кІҪмҡ° л‘җ к°Җм§Җ нҠ№м„ұмқҖ м •м „ л°Ҹ кіөмң к°’мһ…лӢҲлӢӨ.
нҷ”н•ҷм Ғ нҠ№м„ұ
лӢЁн”„лЎңнҶӨмӮ°
лӘЁл…ён”„лЎңнҶӨмӮ°(monrotic acids)мқҖ лҳҗн•ң лӘЁл…ён”„лЎңнҶӨмӮ°мңјлЎң м•Ңл Өм ё мһҲмңјл©°, м•„лһҳмҷҖ к°ҷмқҙ н•ҙлҰ¬ кіјм •(мқҙмҳЁнҷ”лқјкі лҸ„ н•Ё) лҸҷм•Ҳ 분мһҗлӢ№ н•ҳлӮҳмқҳ м–‘м„ұмһҗлҘј кё°мҰқн• мҲҳ мһҲлҠ” мӮ°мқҙлӢӨ.
- HA(aq) + HO2(l) вҖ HO3+(aq) + AвҲ’(aq) Ka
лҜёл„Өлһ„мӮ°м—җ нҸ¬н•Ёлҗң лӘЁл…ён”„лЎңнӢұмӮ°мқҳ мқјл°ҳм Ғмқё мҳҲлЎңлҠ” м—јмӮ°(HCl)кіј м§ҲмӮ°(HNO3)мқҙ мһҲмҠөлӢҲлӢӨ.н•ңнҺё мң кё°мӮ°мқҳ кІҪмҡ° мқҙ мҡ©м–ҙлҠ” мЈјлЎң н•ҳлӮҳмқҳ м№ҙлҘҙліёмӮ° к·ёлЈ№мқҳ мЎҙмһ¬лҘј лӮҳнғҖлӮҙл©°, л•ҢлЎңлҠ” мқҙлҹ¬н•ң мӮ°мқ„ лӘЁл…ём№ҙлҘҙліёмӮ°мқҙлқјкі н•ңлӢӨ.мң кё°мӮ°мқҳ мҳҲлЎңлҠ” нҸ¬лҰ„мӮ°(HCOOH), м•„м„ёнҠёмӮ°(CHCOOH3) л°Ҹ лІӨмЎ°мӮ°(CHCOOH65)мқҙ мһҲлӢӨ.
нҸҙлҰ¬н”„лЎңнӢҙмӮ°
нҸҙлҰ¬м—јкё°мӮ°мңјлЎңлҸ„ м•Ңл Ө진 нҸҙлҰ¬н”„лЎңнӢҙмӮ°мқҖ 분мһҗлӢ№ н•ҳлӮҳмқҳ м–‘м„ұмһҗл§Ң кё°мҰқн•ҳлҠ” лӢЁн”„лЎңнҶӨмӮ°кіјлҠ” лҢҖмЎ°м ҒмңјлЎң мӮ° 분мһҗлӢ№ н•ҳлӮҳ мқҙмғҒмқҳ м–‘м„ұмһҗлҘј кё°мҰқн• мҲҳ мһҲлӢӨ.нҠ№м • мң нҳ•мқҳ нҸҙлҰ¬н”„лЎңнӢҙмӮ°мқҖ мқҙм—јкё°мӮ°(лҳҗлҠ” мқҙм—јкё°мӮ°)кіј мӮјм—јкё°мӮ°(лҳҗлҠ” мӮјм—јкё°мӮ°)кіј к°ҷмқҖ ліҙлӢӨ кө¬мІҙм Ғмқё мқҙлҰ„мқ„ к°Җм§Җкі мһҲлӢӨ.лӢЁл°ұм§Ҳкіј н•өмӮ°кіј к°ҷмқҖ мқјл¶Җ кі л¶„мһҗлҠ” л§Өмҡ° л§ҺмқҖ м–‘мқҳ мӮ°м„ұ [10]м–‘м„ұмһҗлҘј к°Җм§Ҳ мҲҳ мһҲлӢӨ.
л””н”„лЎңнҶӨмӮ°(м—¬кё°м„ңлҠ” HAлЎң2 н‘ңмӢңлҗЁ)мқҖ pHм—җ л”°лқј 1к°ң лҳҗлҠ” 2к°ңмқҳ н•ҙлҰ¬лҘј кІӘмқ„ мҲҳ мһҲлӢӨ.к°Ғк°Ғмқҳ н•ҙлҰ¬м—җлҠ” кі мң мқҳ н•ҙлҰ¬ мғҒмҲҳ KмҷҖa1a2 Kк°Җ мһҲмҠөлӢҲлӢӨ.
- HA2(aq) + HO2(l) вҖ HO3+(aq) + HAвҲ’(aq) Ka1
- HAвҲ’(aq) + HO2(l) вҖ HO3+(aq) + A2вҲ’(aq) Ka2
мІ« лІҲм§ё н•ҙлҰ¬ мғҒмҲҳлҠ” мқјл°ҳм ҒмңјлЎң л‘җ лІҲм§ё н•ҙлҰ¬ мғҒмҲҳліҙлӢӨ нҒҪлӢҲлӢӨ(мҰүa1, K > Ka2).мҳҲлҘј л“Өм–ҙ нҷ©мӮ°(HSO24)мқҖ 1к°ңмқҳ м–‘м„ұмһҗлҘј кё°мҰқн•ҳм—¬ Kк°Җa1 л§Өмҡ° нҒ° 2нҷ©мӮ°вҲ’
4 мқҢмқҙмҳЁ(HSO)мқ„ нҳ•м„ұн• мҲҳ мһҲмңјл©°, лӢӨмқҢмңјлЎң 2к°ңмқҳ м–‘м„ұмһҗлҘј кё°мҰқн•ҳм—¬ нҷ©мӮ° мқҢмқҙмҳЁ2вҲ’
4(SOa2)мқ„ нҳ•м„ұн• мҲҳ мһҲлӢӨ.мІ« лІҲм§ё н•ҙлҰ¬мқҳ нҒ°a1 KлҠ” нҷ©мӮ°мқ„ к°•н•ң мӮ°мңјлЎң л§Ңл“ лӢӨ.л§Ҳм°¬к°Җм§ҖлЎң м•Ҫл¶Ҳм•Ҳм •нғ„мӮ°(HCO23)мқҖ 1к°ңмқҳ м–‘м„ұмһҗлҘј мһғм–ҙ мӨ‘нғ„мӮ° мқҢмқҙмҳЁ(HCOвҲ’
3)мқ„ нҳ•м„ұн•ҳкі , 2лІҲм§ё м–‘м„ұмһҗлҘј мһғм–ҙ нғ„мӮ° мқҢмқҙмҳЁ(CO2вҲ’
3)мқ„ нҳ•м„ұн• мҲҳ мһҲлӢӨ.л‘җa K к°’мқҖ лӘЁл‘җa1 мһ‘м§Җл§Ң K > Ka2 мһ…лӢҲлӢӨ.
мӮјлӢЁл°ұм§ҲмӮ°(HA3)мқҖ 1нҡҢ, 2нҡҢ лҳҗлҠ” 3нҡҢмқҳ н•ҙлҰ¬лҘј кІӘмқ„ мҲҳ мһҲмңјл©°, 3к°ңмқҳ н•ҙлҰ¬ мғҒмҲҳлҘј к°Җм§Җкі мһҲлӢӨ(м—¬кё°м„ңa1 K > Ka2 > Ka3).
- HA3(aq) + HO2(l) вҖ HO3+(aq) + HA2вҲ’(aq) Ka1
- HA2вҲ’(aq) + HO2(l) вҖ HO3+(aq) + HA2вҲ’(aq) Ka2
- HA2вҲ’(aq) + HO2(l) вҖ HO3+(aq) + A3вҲ’(aq) Ka3
мӮјн”„лЎңнӢҙмӮ°мқҳ л¬ҙкё°м Ғмқё мҳҲлҠ” ліҙнҶө мқёмӮ°мқҙлқјкі л¶ҲлҰ¬лҠ” мҳӨлҘҙнҶ мқёмӮ°мқҙлӢӨ34.м„ё к°ңмқҳ м–‘м„ұмһҗ лӘЁл‘җ м—°мҶҚм ҒмңјлЎң мҶҗмӢӨлҗҳм–ҙ HPO, к·ёлҰ¬кі 2вҲ’
4 л§Ҳм§Җл§үмңјлЎң2вҲ’
4 мқёмӮ°м—јмқҙлқјкі л¶ҲлҰ¬лҠ”3вҲ’
4 мҳӨлҘҙнҶ мқёмӮ° мқҙмҳЁмқё POлҘј мғқм„ұн• мҲҳ мһҲмҠөлӢҲлӢӨ.мӣҗлһҳмқҳ мқёмӮ° 분мһҗмғҒм—җм„ңмқҳ 3к°ңмқҳ м–‘м„ұмһҗмқҳ мң„м№ҳлҠ” лҸҷмқјн•ҳм§Җл§Ң, мјӨл Ҳ м—јкё°к°Җ мқҢм „н•ҳк°Җ лҚ” л§Һмңјл©ҙ м–‘м„ұмһҗлҘј мһғлҠ” кІғмқҙ м—җл„Ҳм§Җм ҒмңјлЎң лҚң мң лҰ¬н•ҳкё° л•Ңл¬ём—җ м—°мҶҚлҗҳлҠ”a K к°’мқҖ лӢӨлҘҙлӢӨ.мӮјлӢЁл°ұм§ҲмӮ°мқҳ мң кё°м Ғмқё мҳҲлЎңлҠ” кө¬м—°мӮ°мқҙ мһҲмңјл©°, кө¬м—°мӮ°мқҖ м—°мҶҚм ҒмңјлЎң 3к°ңмқҳ м–‘м„ұмһҗлҘј мһғкі мөңмў…м ҒмңјлЎң кө¬м—°мӮ° мқҙмҳЁмқ„ нҳ•м„ұн• мҲҳ мһҲлӢӨ.
к°Ғ мҲҳмҶҢ мқҙмҳЁмқҳ нӣ„мҶҚ мҶҗмӢӨмқҖ лҚң л°”лһҢм§Ғн•ҳм§Җл§Ң, лӘЁл“ мјӨл Ҳ м—јкё°лҠ” мҡ©м•Ўм—җ мЎҙмһ¬н•ңлӢӨ.к°Ғ мў…м—җ лҢҖн•ң 분мҲҳ лҶҚлҸ„Оұ(alpha)лҘј кі„мӮ°н• мҲҳ мһҲлӢӨ.мҳҲлҘј л“Өм–ҙ мқјл°ҳ л””н”„лЎңнҶӨмӮ°мқҖ мҡ©м•Ўм—җм„ң HA, HAвҲ’, Aмқҳ2вҲ’ 3мў…мқ„2 мғқм„ұн•ңлӢӨ.pH([H+]лЎң ліҖнҷҳн• мҲҳ мһҲмқҢ) лҳҗлҠ” мӮ°мқҳ лҶҚлҸ„мҷҖ лӘЁл“ мјӨл Ҳ м—јкё°к°Җ мЈјм–ҙмЎҢмқ„ л•Ң, л¶Җ분 лҶҚлҸ„лҠ” лӢӨмқҢкіј к°ҷмқҙ кі„мӮ°н• мҲҳ мһҲлӢӨ.
мЈјм–ҙ진1 KмҷҖ2 Kм—җ лҢҖн•ң pHм—җ лҢҖн•ң мқҙлҹ¬н•ң л¶Җ분 лҶҚлҸ„мқҳ н”ҢлЎҜмқҖ Bjerrum н”ҢлЎҜмңјлЎң м•Ңл Өм ё мһҲлӢӨ.мң„мқҳ кіөмӢқм—җм„ң нҢЁн„ҙмқҙ кҙҖм°°лҗҳл©°, нғҲм–‘м„ұмһҗнҷ”лҗң мқјл°ҳм Ғмқё n -н”„лЎңнӢҙмӮ°мңјлЎң нҷ•мһҘлҗ мҲҳ мһҲмҠөлӢҲлӢӨ.
м—¬кё°м„ң0 K = 1 л°Ҹ кё°нғҖ K-н•ӯмқҖ мӮ°мқҳ н•ҙлҰ¬ мғҒмҲҳмқҙлӢӨ.
мӨ‘нҷ”
мӨ‘нҷ”лһҖ мӮ°кіј м—јкё° мӮ¬мқҙмқҳ л°ҳмқ‘мңјлЎң мҶҢкёҲкіј мӨ‘нҷ” м—јкё°лҘј мғқм„ұн•ҳлҠ” кІғмһ…лӢҲлӢӨ. мҳҲлҘј л“Өм–ҙ м—јмӮ°кіј мҲҳмӮ°нҷ”лӮҳнҠёлҘЁмқҖ м—јнҷ”лӮҳнҠёлҘЁкіј л¬јмқ„ нҳ•м„ұн•©лӢҲлӢӨ.
- HCl(aq) + NaOH(aq) вҶ’ HO2(l) + NaCl(aq)
мӨ‘м„ұнҷ”лҠ” м Ғм •мқҳ кё°мҙҲмқҙл©°, м—¬кё°м„ң pH н‘ңмӢңкё°лҠ” мӮ°м—җ л“ұк°Җ лӘ° мҲҳлҘј лҚ”н–Ҳмқ„ л•Ң лӢ№лҹүм җмқ„ лӮҳнғҖлӮёлӢӨ.мӨ‘нҷ” мӢң pH 7.0 мҡ©м•Ўмқҙ мғқм„ұлҗҳм–ҙм•ј н•ңлӢӨкі мһҳлӘ» к°Җм •н•ҳлҠ” кІҪмҡ°к°Җ л§ҺмқҖлҚ°, мқҙлҠ” л°ҳмқ‘ мӨ‘ мӮ°кіј м—јкё° к°•лҸ„к°Җ мң мӮ¬н•ң кІҪмҡ°м—җл§Ң н•ҙлӢ№лҗңлӢӨ.
мӮ°ліҙлӢӨ м•Ҫн•ң м—јкё°лЎң мӨ‘нҷ”мӢңнӮӨл©ҙ м•ҪмӮ°м„ұ 염분мқҙ лҗңлӢӨ.мҳҲлҘј л“Өм–ҙ к°•мӮ°м—јнҷ”мҲҳмҶҢмҷҖ м•Ҫм—јкё° м•”лӘЁлӢҲм•„м—җм„ң мғқм„ұлҗҳлҠ” м•ҪмӮ°м—јнҷ”м•”лӘЁлҠ„мқҙ мһҲлӢӨ.л°ҳлҢҖлЎң м•Ҫн•ң мӮ°мқ„ к°•н•ң м—јкё°лЎң мӨ‘нҷ”н•ҳл©ҙ м•Ҫн•ң м—јкё°м„ұ мҶҢкёҲ(мҳҲлҘј л“Өм–ҙ л¶Ҳнҷ”мҲҳмҶҢмқҳ н”ҢлЈЁмҳӨлҘҙнҷ”лӮҳнҠёлҘЁкіј мҲҳмӮ°нҷ”лӮҳнҠёлҘЁ)мқ„ м–»мқ„ мҲҳ мһҲлӢӨ.
м•ҪмӮ°-м•Ҫм—јкё°к· нҳ•
м–‘м„ұмһҗнҷ”лҗң мӮ°мқҙ м–‘м„ұмһҗлҘј мһғкё° мң„н•ҙм„ңлҠ” мӢңмҠӨн…ңмқҳ pHк°Җ мӮ°мқҳ pKліҙлӢӨa лҶ’м•„м•ј н•ңлӢӨ.кё°ліё мҡ©м•Ўм—җм„ң к°җмҶҢлҗң+ H лҶҚлҸ„лҠ” кІ°н•© м—јкё° нҳ•нғң(мӮ°мқҳ нғҲм–‘м„ұмһҗ нҳ•нғң)лЎң нҸүнҳ•мқ„ мқҙлҸҷмӢңнӮЁлӢӨ.лӮ®мқҖ pH(лҚ” мӮ°м„ұ) мҡ©м•Ўм—җм„ңлҠ” мӮ°мқҙ м–‘м„ұмһҗнҷ”лҗң нҳ•нғңлҘј мң м§Җн• мҲҳ мһҲмқ„ л§ҢнҒј+ мҡ©м•Ўм—җ лҶ’мқҖ H лҶҚлҸ„к°Җ мһҲмҠөлӢҲлӢӨ.
м•Ҫн•ң мӮ°мқҳ мҡ©м•Ўкіј к·ё кІ°н•© м—јкё°мқҳ м—јмқҖ мҷ„충 мҡ©м•Ўмқ„ нҳ•м„ұн•ңлӢӨ.
м Ғм •
мҲҳмҡ©м•Ў мӨ‘ мӮ°мқҳ лҶҚлҸ„лҘј мёЎм •н•ҳкё° мң„н•ҙ мқјл°ҳм ҒмңјлЎң мӮ°-м—јкё°м Ғм •мқ„ мӢӨмӢңн•ңлӢӨ.мқјл°ҳм ҒмңјлЎң NaOH лҳҗлҠ” KOHлЎң м•Ңл Ө진 лҶҚлҸ„мқҳ к°•н•ң м—јкё°мҡ©м•Ўмқ„ мІЁк°Җн•ҳм—¬ мІЁк°Җлҗң [11]м—јкё°мқҳ м–‘м—җ л”°лқј мқёл””мјҖмқҙн„°мқҳ мғүліҖнҷ”м—җ л”°лқј мӮ°мҡ©м•Ўмқ„ мӨ‘нҷ”мӢңнӮЁлӢӨ.м—јкё°м—җ мқҳн•ҙ м Ғм •лҗң мӮ°мқҳ м Ғм •кіЎм„ мқҖ 2к°ңмқҳ 축мқ„ к°Җм§Җл©°, x축мқҖ base volume, y축мқҖ мҡ©м•Ўмқҳ pHк°’мқҙлӢӨ.мҡ©м•Ўмқҳ pHлҠ” лІ мқҙмҠӨк°Җ мҶ”лЈЁм…ҳм—җ 추к°Җлҗҳл©ҙ н•ӯмғҒ мғҒмҠ№н•©лӢҲлӢӨ.
мҳҲ: л””н”„лЎңнҶӨмӮ°
к°Ғ л””н”„лЎңнҶӨмӮ° м Ғм •кіЎм„ м—җ лҢҖн•ҙ мҷјмӘҪм—җм„ң мҳӨлҘёмӘҪмңјлЎң мӨ‘к°„м җ 2к°ң, лӢ№лҹүм җ 2к°ң, мҷ„충мҳҒм—ӯ [13]2к°ңк°Җ мһҲлӢӨ.
л“ұк°Җм җ
м—°мҶҚм Ғмқё н•ҙлҰ¬ мһ‘мҡ©м—җ мқҳн•ҙ, л””н”„лЎңнҶӨмӮ°мқҳ [14]м Ғм • кіЎм„ м—җлҠ” 2к°ңмқҳ лӢ№лҹүм җмқҙ мһҲлӢӨ.мІ« лІҲм§ё лӢ№лҹүм җмқҖ мІ« лІҲм§ё мқҙмҳЁнҷ”мқҳ лӘЁл“ мІ« лІҲм§ё мҲҳмҶҢ мқҙмҳЁмқҙ [15]м Ғм •лҗ л•Ң л°ңмғқн•©лӢҲлӢӨ.мҰү, 추к°Җлҗң OHмқҳ м–‘мқҖвҲ’ мІ« лІҲм§ё л“ұк°Җм җмқҳ мӣҗлһҳ HAмқҳ м–‘кіј2 лҸҷмқјн•©лӢҲлӢӨ.л‘җ лІҲм§ё лӢ№лҹүм җмқҖ лӘЁл“ мҲҳмҶҢ мқҙмҳЁмқҙ м Ғм •лҗ л•Ң л°ңмғқн•©лӢҲлӢӨ.л”°лқјм„ң 추к°Җлҗң OHмқҳ м–‘мқҖвҲ’ нҳ„мһ¬ HAмқҳ 2л°°м—җ2 н•ҙлӢ№н•©лӢҲлӢӨ.к°•н•ң м—јкё°м—җ мқҳн•ҙ м Ғм •лҗң м•Ҫн•ң мқҙмӨ‘мҲҳмҶҢмӮ°мқҖ [15]мҡ©м•Ўм—җм„ң мғқм„ұлҗң м—јлҘҳмқҳ к°ҖмҲҳ분н•ҙлЎң мқён•ҙ pH 7 мқҙмғҒм—җм„ң л‘җ лІҲм§ё лӢ№лҹүм җмқҙ л°ңмғқн•ҙм•ј н•ңлӢӨ.м–ҙлҠҗ л“ұк°Җм җм—җм„ңлӮҳ м—јкё°мқҳ к°•н•ҳлҘј 추к°Җн•ҳл©ҙ мӢңмҠӨн…ңм—җм„ң pH к°’мқҙ к°ҖмһҘ к°ҖнҢҢлҘҙкІҢ мғҒмҠ№н•©лӢҲлӢӨ.
лІ„нҚј мҳҒм—ӯ л°Ҹ мӨ‘к°„м җ
pH=pKмқёa 2к°ңмқҳ мӨ‘к°„м җмқ„ нҸ¬н•Ён•ҳлҠ” л””н”„лЎңнҶӨмӮ° м Ғм •кіЎм„ .л‘җ к°ңмқҳ лӢӨлҘёa K к°’мқҙ мһҲкё° л•Ңл¬ём—җ мІ« лІҲм§ё мӨ‘к°„м җмқҖ pH=pKмқҙкі a1 л‘җ лІҲм§ё мӨ‘к°„м җмқҖ pH=pKмқҙлӢӨa2.[16]мӨ‘мӢ¬м—җ мӨ‘к°„м җмқ„ нҸ¬н•Ён•ҳлҠ” кіЎм„ мқҳ к°Ғ м„ёк·ёлЁјнҠёлҘј лІ„нҚј мҳҒм—ӯмқҙлқјкі н•©лӢҲлӢӨ.мҷ„충 мҳҒм—ӯмқҖ мӮ°кіј к·ё мјӨл Ҳ м—јкё°лЎң кө¬м„ұлҗҳкё° л•Ңл¬ём—җ м—јкё°к°Җ мІЁк°Җлҗ л•Ң лӢӨмқҢ [5]л“ұк°Җм җк№Ңм§Җ pH ліҖнҷ”м—җ м Җн•ӯн• мҲҳ мһҲлӢӨ.
мӮ°мқҳ лҸ„нҸ¬н•Ё
мӮ°мқҖ мҡ°лҰ¬ мӮ¶м—җ ліҙнҺём ҒмңјлЎң мЎҙмһ¬н•ңлӢӨ.мғқл¬јн•ҷм Ғ кё°лҠҘмқ„ к°Җ진 мҲҳл§ҺмқҖ мў…лҘҳмқҳ мІңм—°мӮ° нҷ”н•©л¬јкіј л§ҺмқҖ л°©лІ•мңјлЎң мӮ¬мҡ©лҗҳлҠ” кұ°лҢҖн•ң н•©м„ұмӮ°мқҙ мһҲлӢӨ.
м—…кі„м—җм„ңлҠ”
мӮ°мқҖ мҳӨлҠҳлӮ мӮ°м—…мқҳ кұ°мқҳ лӘЁл“ кіөм •мқ„ мІҳлҰ¬н•ҳлҠ” лҚ° мһҲм–ҙ кё°ліём Ғмқё мӢңм•Ҫмһ…лӢҲлӢӨ.мқҙн”„лЎңнҶӨмӮ°мқё нҷ©мӮ°мқҖ мӮ°м—…м—җм„ң к°ҖмһҘ л„җлҰ¬ мӮ¬мҡ©лҗҳлҠ” мӮ°мқҙл©° м„ёкі„м—җм„ң к°ҖмһҘ л§Һмқҙ мғқмӮ°лҗҳлҠ” кіөм—…мҡ© нҷ”н•ҷл¬јм§Ҳмқҙкё°лҸ„ н•ҳлӢӨ.к·ёкІғмқҖ мЈјлЎң 비лЈҢ, м„ём ң, м „м§Җ, м—јлЈҢлҘј мғқмӮ°н•ҳлҠ”лҚ° мӮ¬мҡ©лҗҳл©° л¶ҲмҲңл¬ј [17]м ңкұ°мҷҖ к°ҷмқҖ л§ҺмқҖ м ңн’Ҳл“Өмқ„ к°Җкіөн•ҳлҠ”лҚ° мӮ¬мҡ©лҗңлӢӨ.2011л…„мқҳ нҶөкі„ лҚ°мқҙн„°м—җ мқҳн•ҳл©ҙ,[18] нҷ©мӮ°мқҳ м—°к°„ мғқмӮ°лҹүмқҖ м„ёкі„ м•Ҫ 2м–ө нҶӨмқҙм—ҲмҠөлӢҲлӢӨ.мҳҲлҘј л“Өм–ҙ мқёмӮ°м—ј кҙ‘л¬јмқҙ нҷ©мӮ°кіј л°ҳмқ‘н•ҳм—¬ мқёмӮ°м—ј 비лЈҢ м ңмЎ°мҡ© мқёмӮ°м—јмқ„ мғқм„ұн•ҳкі , м•„м—°мқҖ м•„м—°мқ„ нҷ©мӮ°м—җ мҡ©н•ҙн•ҳм—¬ мҡ©м•Ўмқ„ м •м ңн•ҳм—¬ мқјл үнҠёлЎңмһүн•ҳм—¬ м ңмЎ°н•ңлӢӨ.
нҷ”н•ҷ мӮ°м—…м—җм„ңлҠ” мӮ°мқҙ мӨ‘нҷ” л°ҳмқ‘мңјлЎң л°ҳмқ‘н•ҳм—¬ мҶҢкёҲмқ„ мғқм„ұн•ңлӢӨ.мҳҲлҘј л“Өм–ҙ, м§ҲмӮ°мқҖ м•”лӘЁлӢҲм•„мҷҖ л°ҳмқ‘н•ҳм—¬ 비лЈҢмқё м§ҲмӮ°м•”лӘЁлҠ„мқ„ мғқм„ұн•ңлӢӨ.л