క్రోమియం(IV)ఆక్సైడ్
| |
| పేర్లు | |
|---|---|
| IUPAC నామము
Chromium(IV) oxide, Chromium dioxide
| |
| ఇతర పేర్లు
Crolyn
magtrieve | |
| గుర్తింపు విషయాలు | |
| సి.ఎ.ఎస్. సంఖ్య | [12018-01-8] |
| పబ్ కెమ్ | 176261494 |
| సి.హెచ్.ఇ.బి.ఐ | CHEBI:48263 |
| ఆర్.టి.ఇ.సి.యస్. సంఖ్య | GB6400000 |
| SMILES | O=[Cr]=O |
| |
| ధర్మములు | |
| CrO2 | |
| మోలార్ ద్రవ్యరాశి | 83.9949 g/mol |
| స్వరూపం | black tetrahedral ferromagnetic crystals |
| సాంద్రత | 4.89 g/cm3 |
| ద్రవీభవన స్థానం | 375 °C (707 °F; 648 K) (decomposes) |
| Insoluble | |
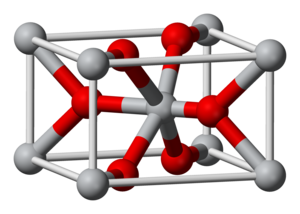
| నిర్మాణం | |
స్ఫటిక నిర్మాణం
|
Rutile (tetragonal), tP6 |
| P42/mnm, No. 136 | |
| ప్రమాదాలు | |
| భద్రత సమాచార పత్రము | ICSC 1310 |
| జ్వలన స్థానం | {{{value}}} |
| US health exposure limits (NIOSH): | |
PEL (Permissible)
|
TWA 1 mg/m3[2] |
REL (Recommended)
|
TWA 0.5 mg/m3[2] |
IDLH (Immediate danger)
|
250 mg/m3[2] |
| సంబంధిత సమ్మేళనాలు | |
ఇతర కాటయాన్లు
|
Vanadium(IV) oxide Manganese(IV) oxide |
| Related {{{label}}} | {{{value}}} |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
క్రోమియం(IV)ఆక్సైడ్ ఒక అకర్బన రసాయన సంయోగ పదార్ధం.క్రోమియం(IV)ఆక్సైడ్ యొక్క రసాయన ఫార్ములా CrO2.క్రోమియం, ఆక్సిజన్ మూలక పరమాణు సంయోగం వలన ఈ సమ్మేళన పదార్ధం ఏర్పడినది. ఇది నల్లని సింథటిక్ మాగ్నటిక్ ఘన పదార్థం.ఒకప్పుడు దీనిని విరివిగా మాగ్నటిక్ టేపులలో ఏమల్షనుగా విరివిగా ఉపయోగించారు. కాలానుగుణంగా CD ల, DVD ల వాడకం పెరిగి, టేపు రికార్డరులు/ప్లేయరుల వాడకం తగ్గడంతో క్రోమియం(IV)ఆక్సైడ్ యొక్క వినియోగం తగ్గినది. అయినప్పటికీ ఇప్పటికి కొన్నిరకాల డాటాటేపుల తయారీలో వాడుచున్నారు. ఇప్పటికి మాగ్నటిక్ టేపు ఉత్పత్తి దారులు క్రోమియం(IV)ఆక్సైడ్ ను ఉత్తమైన మాగ్నటిక్ టేపు పూతరసాయనంగా భావిస్తారు.
తయారి
[మార్చు]ఫ్రేడ్రిచ్ హులేర్(Friedrich Wöhler ) అనునతడు క్రోమైల్ క్లోరైడ్ను వియోగం చెందించి దీనిని తయారు చేసాడు.నార్మల్ ఎల్.కోక్స్ అను రసాయన వేత్త 1956 లో క్రోమియం ట్రై ఆక్సైడ్ నుం వియోగం చెందించి క్రోమియం డయాక్సైడ్ ఉత్పత్తి చేసాడు. 200 MPa వత్తిడి వద్ద నీటి సమక్షంలో 800 K వద్ద క్రోమియం ట్రైఆక్సైడ్ను విఘటన కావించి క్రోమియం(IV)ఆక్సైడ్ను తయారు చేసాడు.[3] ఈ హైడ్రోథర్మల్ సంశ్లేషణ సమతుల్య ఫార్ములా ఈ దిగువ విధంగా :
- 3 CrO3 + Cr2O3 → 5 CrO2 + O2
భౌతిక ధర్మాలు
[మార్చు]నల్లని ఘన పదార్ధం. ఫెర్రో మాగ్నటిక్ గుణములు కలగిన సంయోగ పదార్ధం.చతుర్భుజాకార అణుసౌష్టవాన్ని కల్గిఉన్నది.
అణుభారం
[మార్చు]క్రోమియం(IV)ఆక్సైడ్ యొక్క అణుభారం 83.9949 గ్రాములు/మోల్.[4]
సాధారణ ఉష్ణోగ్రత వద్ద ఈ రసాయన సంయోగ పదార్ధం సాంద్రత 4.85 గ్రాములు/సెం.మీ3[4].
ద్రవీభవన ఉష్ణోగ్రత
[మార్చు]క్రోమియం(IV)ఆక్సైడ్ పదార్హం యొక్క ద్రవీభవన స్థానం/ఉష్ణోగ్రత 375 °C (707 °F; 648 K),ఈ ఉష్ణోగ్రత దాటినా వియోగం చెందును[4].
మరుగు/బాష్పీభవన ఉష్ణోగ్రత
[మార్చు]క్రోమియం(IV)ఆక్సైడ్ పదార్హం యొక్క బాష్పీభవన స్థానం/ఉష్ణోగ్రత:4000 °C [4]
ద్రావణీయత
[మార్చు]నీటిలో కరుగదు.
అనువర్తనాలు
[మార్చు]క్రోమియం(IV)ఆక్సైడ్ ను అధికంగా ఆడియో మాగ్నటిక్ టేపులుతయారీలో వాడుటకు అనుకూలమైన రసాయన పదార్ధం.దీనిని విరివిగా మాగ్నటిక్ టేపులలో ఏమల్షనుగా విరివిగా ఉపయోగించారు. కాలానుగుణంగా CD ల, DVD ల వాడకం పెరిగి, టేపు రికార్డరులు/ప్లేయరుల వాడకం తగ్గడంతో క్రోమియం(IV)ఆక్సైడ్ యొక్క వినియోగం తగ్గినది. అయినప్పటికీ ఇప్పటికి కొన్నిరకాల డాటాటేపుల తయారీలో వాడుచున్నారు. ఇప్పటికి మాగ్నటిక్ టేపు ఉత్పత్తి దారులు క్రోమియం(IV)ఆక్సైడ్ ను ఉత్తమైన మాగ్నటిక్ టేపు పూతరసాయనంగా భావిస్తారు.
ఇవికూడా చూడండి
[మార్చు]మూలాలు/ఆధారాలు
[మార్చు]- ↑ Lide, David R. (1998). Handbook of Chemistry and Physics (87 ed.). Boca Raton, FL: CRC Press. pp. 4–53. ISBN 0-8493-0594-2.
{{cite book}}: CS1 maint: postscript (link) - ↑ 2.0 2.1 2.2 NIOSH Pocket Guide to Chemical Hazards. "#0141". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Chromium(IV) oxide". revolvy.com. Retrieved 2017-03-25.
- ↑ 4.0 4.1 4.2 4.3 "Chromium(IV) Oxide". americanelements.com. Archived from the original on 2017-03-25. Retrieved 2017-03-25.
{{cite web}}: CS1 maint: bot: original URL status unknown (link)
[[వర్గం:క్రోమియం సమ్మేళనాలు]]