Configurazione elettronica
In meccanica quantistica, il termine configurazione elettronica si riferisce alla disposizione degli elettroni legati, ossia al loro comportamento attorno ai nuclei di uno o più atomi.
Orbitali gli stati, e le funzioni d'onda
[modifica | modifica wikitesto]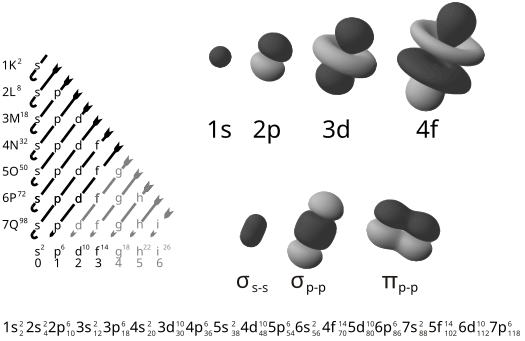
Gli elettroni sono fermioni e in quanto tali sono soggetti al principio di esclusione di Pauli, il quale stabilisce che due fermioni non possono occupare lo stesso stato quantico contemporaneamente. Questo principio è fondamentale nel determinare la configurazione degli elettroni negli atomi: una volta che uno stato viene occupato da un elettrone, l'elettrone successivo deve occupare uno stato differente.
In un atomo, gli stati stazionari (indipendenti dal tempo) di funzione d'onda elettronica (ovvero gli stati che sono stati particolari dell'equazione di Schrödinger HΨ = EΨ dove H è l'hamiltoniana) vengono detti orbitali, per analogia con la visione classica dell'elettrone come particella che orbita attorno al nucleo. Per un atomo multielettronico, con x elettroni, l'espressione corretta della funzione d'onda deve considerare le coordinate spaziali di tutti gli x elettroni contemporaneamente. Ciò, in termini matematici, viene espresso dalla funzione d'onda Ψ = Ψ(n1, n2, n3,...nx). Tuttavia, per gli scopi della chimica, viene sfruttata una notevole semplificazione utilizzando la cosiddetta "approssimazione orbitalica": cioè ogni elettrone viene considerato singolarmente come appartenente a un atomo idrogenoide e la carica nucleare Ze, carica che viene utilizzata per calcolare il termine relativo all'energia potenziale da inserire nell'equazione di Schrödinger, viene corretta utilizzando la carica nucleare efficace Zeff. Quindi la forma semplificata della funzione d'onda, utilizzata per descrivere un atomo polielettronico, diviene una funzione del tipo Ψ = Ψ(n1)Ψ(n2)Ψ(n3)...Ψ(nx).
Il quadrato del modulo del valore di Ψ in un punto (ampiezza d'onda complessa) rappresenta la densità di probabilità di trovare l'elettrone in quel punto. Gli orbitali di un atomo sono distinti da quattro numeri quantici: n, l, ml e ms e, per il principio di Pauli, non è possibile che due elettroni abbiano lo stesso valore per tutti e quattro i numeri.
Numero quantico principale (n)
[modifica | modifica wikitesto]Il primo numero quantico n, detto numero quantico principale, determina la distanza media dal nucleo (dimensione dell'orbitale), che aumenta al crescere di n, e la maggior parte dell'energia dell'elettrone (livello energetico = periodo). Elettroni (e orbitali) che condividono n appartengono dunque allo stesso livello di energia, il numero quantico principale inoltre definisce l'energia dell'elettrone.
Il numero quantico principale assume tutti i valori interi positivi in ordine crescente anche se le orbite stazionarie definite della condizione quantistica m × v × r = n × h/(2π) (dove l'unica variabile è n, essendo le altre costanti) sono solamente le prime sette.
I vari livelli correlati ai differenti valori di n vengono a volte detti gusci e (principalmente per ragioni storiche) vengono anche indicati da lettere, come elencato di seguito:[1]
| Valore di n | Lettera | Massimo numero di elettroni nel livello (pari a 2 × n2) |
|---|---|---|
| 1 | K | 2 |
| 2 | L | 8 |
| 3 | M | 18 |
| 4 | N | 32 |
| 5 | O | 50 |
| 6 | P | 72 |
| 7 | Q | 98 |
| 8 | Y | 113 |
Stati con valori di n superiori a quelli mostrati nella tabella sono perfettamente ammissibili in teoria ma relativi ad atomi che non sono stati ancora scoperti (il valore n=8, ad esempio, si inizierà a utilizzare con elementi aventi numero atomico superiore a 119).
Numero quantico orbitale (l)
[modifica | modifica wikitesto]Il secondo numero quantico l, detto numero quantico orbitale (o, più impropriamente, numero quantico secondario o azimutale o angolare o rotazionale), corrisponde al momento angolare dello stato. Questi stati prendono la forma di un'armonica sferica e sono quindi descritti da polinomi di Legendre.
Per ogni valore di n, il numero quantico orbitale assume in ordine crescente tutti i valori interi compresi tra 0 e n-1.
I vari stati correlati ai differenti valori di l vengono a volte detti "sottolivelli" o "sottogusci" e (principalmente per ragioni storiche) vengono anche indicati da lettere, come elencato di seguito:[1]
| Valore di l | Lettera | Massimo numero di elettroni nel sottolivello (pari a (2 × l + 1) × 2) |
|---|---|---|
| 0 | s | 2 |
| 1 | p | 6 |
| 2 | d | 10 |
| 3 | f | 14 |
| ... | ... | ... |
Anche in questo caso, stati con valori di l superiori a quelli mostrati nella tabella sono perfettamente ammissibili in teoria ma relativi ad atomi che non sono stati ancora scoperti (il valore l=4, ad esempio, si inizierà a utilizzare con elementi aventi numero atomico superiore a 121).
Numero quantico magnetico (ml) e numero quantico di spin (ms)
[modifica | modifica wikitesto]Come abbiamo visto, ogni sottoguscio può accogliere 2(2l+1) elettroni. Questo perché, per ogni valore di l, il terzo numero quantico ml, detto numero quantico magnetico (che può essere pensato in maniera inaccurata come la proiezione quantizzata del vettore momento angolare sull'asse z), assume in ordine crescente tutti i valori interi compresi tra -l e l, e quindi ci sono 2l+1 stati possibili. Ogni stato distinto n-l-ml può essere occupato da due elettroni con spin opposto (dato dal quarto numero quantico ms, detto numero quantico di spin, che per ogni valore di ml assume i due valori -1/2 e +1/2), dando così un totale di appunto 2(2l+1) elettroni.
Ordine di riempimento degli stati quantici e relazione con la struttura della tavola periodica
[modifica | modifica wikitesto]Allo stato fondamentale, gli stati quantici di un atomo sono riempiti in ordine crescente di energia, secondo il principio dell'Aufbau; ovvero, il primo elettrone va a occupare lo stato libero con energia più bassa e così via. Il fatto che lo stato 3d sia più alto, come energia, dello stato 4s, ma più basso del 4p è il motivo per l'esistenza dei metalli del blocco d. L'ordine in cui gli stati vengono riempiti è il seguente:
| 1s | ... | |||
| 2s | ... | 2p | ||
| 3s | ... | 3p | ||
| 4s | ... | 3d | 4p | |
| 5s | ... | 4d | 5p | |
| 6s | ... | 4f | 5d | 6p |
| 7s | ... | 5f | 6d | 7p |
Ciò porta direttamente alla struttura della tavola periodica. Difatti le configurazioni orbitali sono state ricavate da un fattore logico: le valenze rispettano un ordine ben definibile solo fino a Ca, dopodiché riprendono tale ordine da Ga, ma tra essi si trovano altri 10 elementi identificati dai parametri di peso nella tavola, e che non seguono un preciso ordine periodico di valenza (che è molto variabile a seconda delle condizioni; in generale sono molto simili tra loro): viene definita "periodicità ridotta"; di conseguenza è stato ritenuto che a partire da Sc, l'orbitale esterno rimanga lo stesso di Ca (per quanto accettato che le condizioni di natura fisica possano portare una variazione), ed a crescere è il penultimo, da 9 del primo dopo Ca, cioè Sc, a 18 dell'ultimo prima di Ga, cioè Zn; tale progressione logica riprende poi dopo Sr fino a Cd, sempre col risultato di 18 elettroni orbitanti; dopo Ba però non vi sono più solo 10 elementi a separare, ma 24, ragion per cui gli orbitanti diventano 32 fino ad Hg. Diversi dati empirici hanno poi confermato tale teoria, in particolare le caratteristiche similari tra i metalli alcalino terrosi e quelli del gruppo 12, ed il fatto che il gruppo 11 sia quello con la maggiore conduttività elettrica. Le proprietà chimiche di un atomo sono largamente determinate dalla disposizione degli elettroni del guscio più esterno, il guscio di valenza (anche se altri fattori, come raggio atomico, peso atomico, e l'aumentata accessibilità a stati elettronici addizionali contribuiscono alla chimica degli elementi, man mano che le dimensioni degli atomi aumentano).
Progredendo attraverso un gruppo, dall'elemento più leggero a quello più pesante, i gusci elettronici esterni (quelli che partecipano più facilmente alle reazioni chimiche) sono tutti nello stesso tipo di orbitale, con forme simili, ma con un sempre maggiore livello di energia e distanza media dal nucleo. Ad esempio, i gusci esterni degli elementi del primo gruppo, introdotto dall'idrogeno, hanno tutti un elettrone nell'orbitale s. Nell'idrogeno, l'orbitale s è nel più basso stato di energia possibile per ogni atomo (ed è rappresentato dalla posizione dell'idrogeno nel primo periodo della tavola periodica). Nel francio, l'elemento più pesante del gruppo, il guscio esterno si trova nel settimo orbitale, decisamente più lontano dal nucleo rispetto agli elettroni che riempiono i gusci sottostanti. Come altro esempio: sia il carbonio sia il piombo hanno quattro elettroni nell'orbitale del guscio esterno.
A causa dell'importanza del guscio esterno, le differenti regioni della tavola periodica sono a volte dette "blocchi della tavola periodica", chiamati secondo il sottoguscio nel quale risiede l'ultimo elettrone: blocco s, blocco p, blocco d, ecc.
Notazioni e semplificazioni
[modifica | modifica wikitesto]Orbitali atomici
[modifica | modifica wikitesto]L'ordine di riempimento degli orbitali, in ordine crescente di energia è il seguente:
- 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p.
Da quanto si può notare non sono tutti ordinati secondo lo stesso numero quantico n. Questo fenomeno è dovuto al fatto che in un atomo gli elettroni si dispongono occupando dapprima gli orbitali a minore energia e via via quelli a maggiore energia. L'energia di un orbitale aumenta all'aumentare del numero quantico principale e a parità di n aumenta all'aumentare del numero quantico angolare l, cioè nell'ordine s, p, d, f. Combinando questi due valori, può quindi accadere che l'energia di un orbitale di un livello superiore, per esempio 4s sia minore di quella di un orbitale appartenente a un livello inferiore, per esempio 3d. Alcuni sottolivelli possono cioè "invadere" i livelli energetici adiacenti.
Un esempio della notazione comunemente usata per esprimere la configurazione elettronica di un atomo, nel caso del silicio, è il seguente:
- 1s2 2s2 2p6 3s2 3p2
I numeri sono i numeri dei gusci, n; le lettere si riferiscono agli stati del momento angolare e i numeri sovrascritti sono i numeri degli elettroni in quello stato per l'atomo in questione.[2] Una versione più semplice è quella di elencare il numero di elettroni di ogni guscio, ad esempio, sempre per il silicio:
- 2-8-4
Altra esemplificazione, molto utilizzata nella pratica comune, consiste nell'evidenziare i gusci più esterni esprimendo i livelli energetici precedenti tramite abbreviazione che rimanda alla configurazione del gas nobile immediatamente precedente l'elemento in oggetto.
Ad esempio, considerando sempre il silicio, la configurazione elettronica può essere espressa nella seguente forma contratta:
- [Ne] 3s2 3p2
dove [Ne] indica la configurazione elettronica del neon.
Il modo più completo per rappresentare la configurazione elettronica degli orbitali atomici consiste nel rappresentare ogni livello energetico come una cella, dentro la quale vengono indicati gli elettroni con delle frecce; nel caso di doppietti elettronici tali frecce hanno verso opposto, in modo da sottolineare che gli elettroni di uno stesso livello energetico presentano spin opposti.[3] Di seguito viene riportata come esempio la configurazione elettronica del silicio:
|
|
|
|
| ||||||||||||||||||||||||||||
Talvolta le celle appartenenti allo stesso numero quantico principale vengono evidenziate con lo stesso colore:[3]
|
|
|
|
| ||||||||||||||||||||||||||||
Orbitali molecolari
[modifica | modifica wikitesto]La rappresentazione degli orbitali molecolari è invece più complessa; ad esempio nel caso della molecola di ossigeno (O2) si ha la seguente rappresentazione:

In questo caso, in giallo sono indicati gli orbitali atomici di ciascun atomo di ossigeno e in rosa sono indicati gli orbitali molecolari della molecola di O2, che derivano dalla combinazione degli orbitali atomici.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- Luigi Rolla, Chimica e mineralogia. Per le Scuole superiori, 29ª ed., Dante Alighieri, 1987.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto]Wikimedia Commons contiene immagini o altri file su configurazione elettronica
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) IUPAC Gold Book, "configuration (electronic)", su goldbook.iupac.org.
- (EN) chemguide, "Electronic Structure", su chemguide.co.uk.
| Controllo di autorità | GND (DE) 4263652-8 |
|---|