Ruténium-tetroxid
| Ruténium(VIII)-oxid | |
 |

|
| IUPAC-név | ruténium(VIII)-oxid |
| Kémiai azonosítók | |
|---|---|
| CAS-szám | 20427-56-9 |
| PubChem | 119079 |
| Kémiai és fizikai tulajdonságok | |
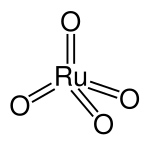
| Kémiai képlet | RuO4 |
| Moláris tömeg | 165,07 g/mol |
| Megjelenés | sárga színű, könnyen megolvadó szilárd anyag |
| Szag | pungent |
| Sűrűség | 3,29 g/cm3 |
| Olvadáspont | 25,4 °C |
| Forráspont | 40,0 °C |
| Oldhatóság (vízben) | 2% w/v (20 °C-on) |
| Oldhatóság (más oldószerek) | oldódik szén-tetrakloridban, kloroformban |
| Kristályszerkezet | |
| Molekulaforma | tetraéderes |
| Dipólusmomentum | nulla |
| Veszélyek | |
| NFPA 704 | |
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |
A ruténium-tetroxid (más néven ruténium(VIII)-oxid) szervetlen vegyület, képlete RuO4. Sárga színű, illékony szilárd anyag, mely nem sokkal szobahőmérséklet felett megolvad.[1] A szennyezések miatt sokszor fekete színű. A vele analóg OsO4 jobban ismert és gyakrabban használt vegyület. Csak néhány oldószerben képez stabil oldatot, ezek egyike a CCl4.[2]
Előállítása
[szerkesztés]Ruténium(III)-klorid NaIO4-os oxidációjával állítják elő.[1]
- 8 Ru3+(aq) + 5 IO−4(aq) + 12 H2O(l) → 8 RuO4(s) + 5 I−(aq) + 24 H+(aq)
Ára, mérgező volta és nagy reakciókészsége miatt a szerves kémiai reakciókhoz gyakran in situ állítják elő, és katalitikus mennyiségben használják, ilyenkor szubsztöchiometrikus mennyiségű ruténium(III) vagy -(IV) vegyülethez adnak sztöchiometrikus mennyiségű nátrium-metaperjodátot (mint végső oxidálószert), ami folyamatosan regenerálja a kis mennyiségű RuO4-ot. A RuO4 oxidálószert alkalmazó reakciókban a ruténium számos formája megfelelő prekurzor lehet, leggyakrabban a RuCl3·xH2O vagy RuO2·xH2O használatos.
Szerkezete
[szerkesztés]Molekulája tetraéderes geometriájú, benne a Ru–O kötéshossz 169-170 pm.[3]
Felhasználása
[szerkesztés]A ruténium elkülönítése érceiből
[szerkesztés]Fő kereskedelmi értékét az adja, hogy a ruténiumfém és vegyületeinek ércekből történő előállításának köztiterméke. Más platinafémekhez hasonlóan a ruténium is csak kis koncentrációban, gyakran más platinafémekkel keverve fordul elő. Az OsO4-dal együtt más platinafémektől a klórral oxidált kivonat desztillációjával választják el. A ruténiumot az OsO4-től a RuO4 sósavas redukciójával különítik el, ez az eljárás a [RuO4]0/− redoxipár rendkívül pozitív redukciós potenciálját használja ki.[4][5]
Szerves kémia
[szerkesztés]A szerves kémiában különleges értékkel bír, mivel szinte bármilyen szénhidrogént oxidál. Az adamantánt például 1-adamantanollá oxidálja. Mivel ennyire erélyes oxidálószer, enyhe reakciókörülmények szükségesek, ez általában szobahőmérsékletet jelent. Bár erős oxidálószer, de a nem oxidált sztereocentrumokat érintetlenül hagyja, erre példa az alábbi diol karbonsavvá történő oxidálása:
Epoxid alkoholok oxidációja is a gyűrű felnyílása nélkül megy végbe:
Enyhébb körülmények között az oxidáció aldehidet eredményez. A szekunder alkoholokat készségesen ketonokká alakítja. Bár hasonló eredményt olcsóbb anyagokkal, például piridínium-klorokromát- vagy DMSO-alapú oxidálószerekkel is el lehet érni, a RuO4 ideális, ha nagyon erélyes oxidálószer, de enyhe reakciókörülmény szükséges. A szerves szintézisekben belső alkinek 1,2-diketonokká, valamint terminális alkinek és primer alkoholok karbonsavakká történő oxidációjára használják. Erre a célra katalitikus mennyiségben alkalmazzák, és a ruténium(VIII)-oxid regenerálására nátrium-perjodátot, valamint acetonitril, víz és szén-tetraklorid oldószerelegyet adnak ruténium(III)-kloridhoz. A RuO4 könnyen felhasítja a kettős kötéseket, ekkor karbonilvegyületek keletkeznek, az ozonolízishez hasonló módon. A hasonló, ismertebb oxidálószer, az ozmium(VIII)-oxid nem hasítja fel a kettős kötéseket, hanem vicinális diol terméket szolgáltat. Rövid reakcióidővel és gondosan szabályozott körülmények között azonban a RuO4 is alkalmazható dihidroxilálásra.[6]
Mivel az arének (különösen az elektronban gazdag) arének) „kettős kötéseivel” is reagál dihidroxilálás és a C−C felhasítása révén – amire csak kevés más reagens képes –, ezért felhasználható „védőcsoport eltávolító” reagensként olyan karbonsavaknál, melyek arilcsoportként (jellemzően fenil- vagy p-metoxifenil) vannak álcázva. Mivel maguk a keletkező fragmentumok is könnyen oxidálódnak RuO4 hatására, az arén szénatomok jelentős része egészen szén-dioxidig oxidálódik. Emiatt a végső oxidálószerből több (gyakran aromás gyűrűnként több, mint 10) ekvivalensnyi mennyiség szükséges a karbonsavig történő átalakításhoz, ami csökkenti ezen reakció gyakorlati használhatóságát.[7][8][9]
Bár közvetlen oxidálószerként használják, viszonylag magas költsége miatt – segédoxidálószerrel együtt – katalitikusan is használják. Gyűrűs alkoholok bázisos közegben, bromáttal történő, RuO4 által katalizált oxidációjában első lépésként a RuO4 aktiválódik hidroxidion hatására:
- RuO4 + OH− → HRuO5−
Egyéb felhasználása
[szerkesztés]Felhasználható ujjlenyomatok előhívására. A látens ujjlenyomattal – annak olaj- vagy zsírtartalma miatt – reakcióba lépve a keletkező barna/fekete ruténium-dioxid előhívja a lenyomatot.[10]
Jegyzetek
[szerkesztés]- ↑ a b H. L. Grube.szerk.: G. Brauer: Ruthenium (VIII) Oxide, Handbook of Preparative Inorganic Chemistry, 2nd Ed.. Academic Press, 1599–1600. o. (1963)
- ↑ Ruthenium(VIII) Oxide, Encyclopedia of Reagents for Organic Synthesis. DOI: 10.1002/047084289X.rr009.pub2 (2006). ISBN 978-0471936237
- ↑ (2005) „Two Crystalline Modifications of RuO4”. Journal of Solid State Chemistry 178 (10), 3206–3209. o. DOI:10.1016/j.jssc.2005.07.021.
- ↑ (2005) „A review of methods of separation of the platinum-group metals through their chloro-complexes”. Reactive and Functional Polymers 65 (3), 205–217. o. DOI:10.1016/j.reactfunctpolym.2005.05.011.
- ↑ (2013) „Separation and recovery of ruthenium: a review”. Journal of Radioanalytical and Nuclear Chemistry 298 (2), 781–796. o. DOI:10.1007/s10967-013-2536-5.
- ↑ Plietker, Bernd (2005). „Selectivity versus reactivity - recent advances in RuO4-catalyzed oxidations”. Synthesis 5 (15), 2453–2472. o. DOI:10.1055/s-2005-872172.
- ↑ Nunez, M. Teresa (1990. március 1.). „Efficient oxidation of phenyl groups to carboxylic acids with ruthenium tetraoxide. A simple synthesis of (R)-.gamma.-caprolactone, the pheromone of Trogoderma granarium”. The Journal of Organic Chemistry 55 (6), 1928–1932. o. DOI:10.1021/jo00293a044. ISSN 0022-3263.
- ↑ Nasr, Khaled (2008. február 1.). „Rigid Multivalent Scaffolds Based on Adamantane”. The Journal of Organic Chemistry 73 (3), 1056–1060. o. DOI:10.1021/jo702310g. ISSN 0022-3263. PMID 18179237. PMC 2505186.
- ↑ (2003. február 17.) „Oxidative degradation of benzene rings”. Tetrahedron 59 (8), 1105–1136. o. DOI:10.1016/S0040-4020(02)01492-8. ISSN 0040-4020.
- ↑ (1998) „Latent Fingerprint Processing by the Ruthenium Tetroxide Method”. Journal of Forensic Identification 48 (3), 279–290. o. DOI:10.3408/jasti.2.21.
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Ruthenium tetroxide című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
További olvasnivalók
[szerkesztés]- Chemistry of Precious Metals. London: Chapman and Hall (1997). ISBN 978-0-7514-0413-5
- (2002) „The oxidation of alcohols in substituted imidazolium ionic liquids using ruthenium catalysts”. Green Chemistry 4 (2), 97. o. DOI:10.1039/B109851A.
- (1991) „Kinetics and mechanism of ruthenium tetroxide catalysed oxidation of cyclic alcohols by bromate in a base”. Transition Metal Chemistry 16 (4), 466. o. DOI:10.1007/BF01129466.
- (1972) „Ruthenium tetroxide oxidation”. Reviews of Pure and Applied Chemistry 22, 47. o.



