Metaan
See artikkel vajab toimetamist. (November 2010) |
Artiklis ei ole piisavalt viiteid. |
 
| |
| Üldandmed | |
|---|---|
| Molekulivalem | CH4 |
| Molaarmass | 16,0425 g/mol |
| Agregaatolek | gaas |
| Omadused | |
| Tihedus | 0,716 g/L normaaltingimustel[viide?] või 0,656 g/L 25 °C, 1 atm[viide?] |
| Lahustuvus vees | 35 g/l (17 °C) |
| Sulamistemperatuur | −182,5 °C[1] |
| Keemistemperatuur | −161,6 °C[1] |
| Kolmikpunkt | 90,7 K, 0,117 bar |
| Kriitiline punkt | −82,6 °C rõhul 4,6 MPa |
| Struktuur | |
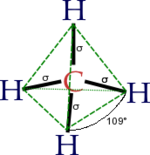
| Molekuli kuju | Tetraeedriline |
| Leekpunkt | −188 °C |
| Süttimistemperatuur | 537 °C |
| Maksimaalne põlemistemperatuur: | 2148 °C |
| Kui pole märgitud teisiti, on andmed antud normaaltingimustel (IUPAC) (0 °C, 1 atm). | |
Metaan ehk metüülhüdriid (molekulivalem CH4) on lihtsaim alkaan ja süsivesinik, küllastunud süsivesinike homoloogilise rea esimene liige.[1]
Füüsikalised omadused
muudaMetaan on värvitu, lõhnatu ja maitsetu gaas.[2]
Metaani tihedus on 0,717 kg/m³ normaaltingimustel (IUPAC)[viide?] ning 0,656 kg/m³ toatemperatuuril ja rõhul 1 atm[viide?].
Metaani molaarmass on 16,0425 g/mol.
Metaani sulamistemperatuur −182,5 °C[1], keemistemperatuur −161,6 °C[1], kolmikpunkt −182,5 °C rõhul 0,117 bar ja kriitiline punkt 82,6 °C rõhul 46 bar.
Metaani molekul on tetraeedrilise kujuga. Sidemenurgad on ümardatult 109,5 kraadi (cos−1(−⅓) = 109,4712206...° ≈ 109,5°). Süsiniku ja vesiniku aatomi vaheline kaugus on 108,70 pikomeetrit.
Metaan on hüdrofoobne.
Keemilised omadused
muudaPõlemine
muudaÜhe metaani molekuli põlemisel eraldub üks süsinikdioksiidi molekul ja kaks molekuli vett:
- CH4 + 2O2 -> CO2 + 2H2O + 891 kJ/mol energiat.
1 kg metaani põlemissoojus on 55 600 kJ.
Metaan põleb sinise leegiga.[3]
Tema leekpunkt on −188 °C, süttimistemperatuur +537 °C ja maksimaalne põlemistemperatuur 2148 °C.
Teised reaktsioonid
muudaSüsiniku ja vesiniku aatomi vahel olev kovalentne side on üks kõige tugevamaid, mida süsivesinikes leida võib, ja sellepärast on metaani kasutamine keemiliste protsesside lähteainena raskendatud.
Mittetäielikul põlemisel ja katalüütilisel oksüdeerumisel muundub metaan metanooliks ja metanaaliks.
Elektrikaares muundub metaan etüüniks.
Lahustumine
muudaMetaan lahustub etanoolis ja atsetoonis. Tema lahustuvus vees on 35 g/l.
Esinemine looduses
muudaMetaan tekib looduses anaeroobsetes tingimustes mikroorganismide (bakterite) elutegevuse käigus orgaanilise aine, eriti tselluloosi lagunemisel (anaeroobne lagunemine). Seda esineb näiteks soodes ja mudastel aladel.[viide?]
Palju metaani on imetajate soolegaasides ning seda eraldub ka mäletsejate sõnnikust. Mäletsejate kasvatamine on suurendanud metaani sisaldust atmosfääris. Arvatakse, et Maal elavad 1,3 miljardit veist paiskavad igal aastal õhku 70 miljonit tonni metaani, mis moodustab veerandi atmosfääri lisanduvast metaanist. Palju metaani tuleb ka riisipõldudelt. Suurem osa atmosfääri metaanist pärinebki tänapäeval karjakasvatusest ja riisikasvatusest. Alates 19. sajandi algusest on metaani sisaldus atmosfääris karjakasvatuse, riisikasvatuse ja muu inimtegevuse tõttu kasvanud umbes 1,7 mahuprotsendi võrra. Inimese tervisele ja loodusele sellel otsest mõju ei ole, kuid metaan osaleb atmosfääris keemilistes reaktsioonides ning on üks olulistest kasvuhoonegaasidest. 1980. aastatel oli metaani osatähtsus kasvuhooneefekti kasvus umbes 15%. Võrreldes süsinikdioksiidiga on tal kõrge globaalse soojenemise potentsiaal: 72 (20 aasta lõikes) või 25 (100 aasta lõikes). Metaani kontsentratsioon atmosfääris on kasvanud ligikaudu 150% aastast 1750[4]. 2000. aastatel on metaani kontsentratsioon atmosfääris on 600 000 aasta kõrgeim.
Metaani eluiga atmosfääris on umbes 10 aastat. Teda kõrvaldab peamiselt reageerimine hüdroksüülradikaalidega (moodustuvad süsinkdioksiid ja vesi).[viide?]
Metaan on maagaasi (60–90%) ja soogaasi peamine komponent. Teda sisaldub ka kaevandusgaasis, naftagaasis ja tahkekütuste uttegaasides. Metaani leidub maapõues söekihtide vahelistes tühimikes, kust ta söe kaevandamisel vabaneb.[viide?]
Ta on orgaaniliste jäätmete ladustamiskohtadest eralduva biogaasi üks põhikomponente.[viide?]
Väljaspool Maad
muudaMetaan on Jupiteri, Saturni, Uraani ja Neptuuni atmosfääri põhikomponent.[viide?]
Derivaadid
muudaMetaani derivaatidest on olulisemad klorometaan, kloroform, tetraklorometaan ja nitrometaan.
Saamine
muudaLaboris saadakse metaani kõige sagedamini naatriumhüdroksiidi ja naatriumetanaadi segu kuumutamisel; tekib ka naatriumkarbonaat:
- NaOH + CH3COONa → CH4 + Na2CO3
Ohutus
muudaMetaan on vähemürgine[viide?] või vähemürgine. Tal on kerge narkootiline toime[viide?].
Metaan on väga kergesti süttiv ja võib koos õhuga moodustada plahvatusohtliku segu. Metaan reageerib plahvatuslikult oksüdeerijate, halogeenide ja veel mõne halogeene sisaldava ainega.[viide?]
Metaan on lämmatav gaas. Kui halvasti ventileeritud suletud ruumi tungivad metaani aurud, võivad need õhust hapniku välja tõrjuda. Kui seda gaasi tükk aega sisse hingata, võib surra lämbumise tõttu. Kuid see metaani kontsentratsioon, milles õhk muutub süttivaks või plahvatusohtlikuks, on palju madalam lämbumist põhjustavast kontsentratsioonist, nii et lämbumine ei ole väga tõsine oht plahvatusohu kõrval.[viide?]
Et maagaasi leket oleks kergem avastada, lisatakse sellele sageli lõhnaaineid.[viide?]
Söekaevandustes tekib plahvatusohtlik gaaside segu, sest söe murdmisel tungib kaevandustesse söekihtide vahelt vabanev metaan.[viide?]
Prügi ladustamise endisesse kohta või prügimäe lähedusse ehitatud majja võib koguneda metaani. Mõne maja keldris on selle jaoks erisüsteemid, mis koguvad keldrist metaani ja kas kasutavad seda maja küttesüsteemis või juhivad selle majast välja, näiteks ventilatsiooni abil.[viide?]
Kasutamine
muudaEt metaani on palju saadaval, kasutatakse teda laialdaselt kütusena ja soojuselektrijaamades elektri tootmiseks. Metaan sisaldub majapidamisgaasis. Teda kasutatakse valgustamiseks ja õli tootmiseks. Et metaan on normaaltingimustel gaas, transporditakse teda peamiselt torujuhtmetes ja vedelgaasitankerites, samuti veoautodega.[viide?]
C-H-sideme purustamiseks vajalikust suurest energiast hoolimata on metaan endiselt vesiniku tööstuslikus tootmises peamine lähteaine. Katalüsaatorite otsimine, mis hõlbustaksid C-H-sideme purustamist metaanis ja teistes madalates alkaanides, on sellepärast tööstuse jaoks olulised.[viide?]
Metaanist saadakse sünteesigaasi, millest omakorda toodetakse näiteks metanooli, ammoniaaki, äädikhapet ja väetisi. Keemiatööstuses on ta üha olulisem süsiniku ja vesiniku allikas.[viide?]
Eestis on metaanist saadud vesinikku kasutatud ammoniaagi tootmisel.[viide?]
Metaani kasutatakse ka näiteks süsinikdisulfiidi, vesiniktsüaniidi, etüüni ja kloroalkaanide tootmisel.[viide?]
Ajalugu
muudaMetaani avastas ja isoleeris esimesena Alessandro Volta ajavahemikus 1776–1778, uurides Lago Maggiore soogaasi.[viide?]
Vaata ka
muudaViited
muuda- ↑ 1,0 1,1 1,2 1,3 1,4 Hergi Karik "Üldine keemia" lk. 179–180
- ↑ ""Füüsikalised omadused"" (inglise). Vaadatud 6.07.2014.
- ↑ ""Metaani värv"" (inglise). Vaadatud 6.07.2014.
- ↑ "Technical summary". Climate Change 2001. United Nations Environment Programme. Originaali arhiivikoopia seisuga 4.06.2011.