„Triazine“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Bot: Ergänze: cs:Triazin |
K Bot: Parameterwerte der Vorlage:H-Sätze ergänzt bzw. angepasst |
||
| (41 dazwischenliegende Versionen von 22 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
{| class="wikitable float-right" style="text-align:center; font-size:90%;" |
|||
[[Image:Triazine_isomers.png|thumb|1) 1,2,3-Triazin,<br /> 2) 1,2,4-Triazin,<br /> 3) 1,3,5-Triazin]] |
|||
|- |
|||
| class="hintergrundfarbe6" colspan="4" | '''Triazine''' |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | Name |
|||
| 1,2,3-Triazin || 1,2,4-Triazin || 1,3,5-Triazin |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | Andere Namen |
|||
| ''v''-Triazin<br />''vic''-Triazin |
|||
| ''as''-Triazin<br />''asym''-Triazin |
|||
| ''s''-Triazin<br />''sym''-Triazin |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Strukturformel]] |
|||
| [[Datei:1,2,3-Triazin - 1,2,3-triazine.svg|80px]] || [[Datei:1,2,4-Triazin - 1,2,4-triazine.svg|75px]] || [[Datei:1,3,5-Triazin - 1,3,5-triazine.svg|80px]] |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[CAS-Nummer]] |
|||
| {{CASRN|289-96-3|Q27117364}} || {{CASRN|290-38-0|Q27117363}} || {{CASRN|290-87-9|Q751744}} |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[EG-Nummer]] |
|||
| 808-989-8 || || 206-028-1 |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[ECHA]]-Infocard |
|||
| {{ECHA|100.236.897}} || || {{ECHA|100.005.481}} |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[PubChem]] |
|||
| {{PubChem|123047}} || {{PubChem|67520}} || {{PubChem|9262}} |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Wikidata]] |
|||
| [[d:Q27117364|Q27117364]] || [[d:Q27117363|Q27117363]] || [[d:Q751744|Q751744]] |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Summenformel]] |
|||
| colspan="3" | C<sub>3</sub>H<sub>3</sub>N<sub>3</sub> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Molare Masse]] |
|||
| colspan="3" | 81,08 g·[[mol]]<sup>−1</sup> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Aggregatzustand]] |
|||
| fest || flüssig || fest |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | Kurzbeschreibung |
|||
| |
|||
| blassgelbes Öl<ref name="Römpp" /> |
|||
| farblose, stark lichtbrechende,<br />rhomboedrische Kristalle<ref name="Römpp" /> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Schmelzpunkt]] |
|||
| 70 °C<ref name="Neunhoeffer">Neunhoeffer, H.; Clausen, M.; Voetter, H.–D.; Ohl, H.; Krueger, C.; Angermund, K.: ''1,2,3‐Triazine, III Synthese von N‐Aminopyrazolen und deren Oxidation zu 1,2,3‐Triazinen. Molekülstruktur des 1,2,3‐Triazins'' in [[Liebigs Ann. Chem.]] 1985, 1732–1751, {{DOI|10.1002/jlac.198519850903}}.</ref> |
|||
| 17 [[Grad Celsius|°C]]<ref name="Römpp">{{RömppOnline|ID=RD-20-02681|Name=Triazine|Abruf=2014-03-04}}</ref> |
|||
| 86 °C<ref name="Römpp" /> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Siedepunkt]] |
|||
| |
|||
| 156 °C<ref name="Römpp" /> |
|||
| 114 °C<ref name="Römpp" /> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Dichte]] |
|||
| 1,448 g·cm<sup>−3</sup><ref name="Neunhoeffer" /> |
|||
| |
|||
| 1,38 g·cm<sup>−3</sup><ref name="Römpp" /> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Löslichkeit]] |
|||
| || || löslich in [[Ethanol]], [[Diethylether]];<br />Zersetzung in Wasser<ref name="Römpp" /> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" | [[Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien|GHS-<br />Kennzeichnung]] |
|||
| {{GHS-Piktogramme|07}}<br />Achtung<ref>{{CL Inventory|ID=246166|harmonisiert=|Name=1,2,3-Triazin|Abruf=2016-07-28}}</ref> |
|||
| {{GHS-Piktogramme|/}} |
|||
| {{GHS-Piktogramme|05|07}}<br />Gefahr<ref name="Sigma">{{Sigma-Aldrich|Aldrich|T46051|Name=s-Triazine, 97%|Abruf=2013-11-06}}</ref> |
|||
|- |
|||
| class="hintergrundfarbe5" align="left" rowspan="2" | [[H- und P-Sätze]] |
|||
| {{H-Sätze|302|315|319|335|KeineKat=ja}} || {{H-Sätze|/}} || {{H-Sätze|302|315|318|335|KeineKat=ja}} |
|||
|- |
|||
| {{P-Sätze|?}} || {{P-Sätze|/}} || {{P-Sätze|261|280|305+351+338}} |
|||
|} |
|||
Als '''Triazine''' wird eine [[Stoffgruppe|Gruppe]] [[Chemische Verbindung|chemischer Verbindungen]] bezeichnet, deren Grundstruktur ein [[aromat]]ischer [[Heterocyclen|Heterocyclus]] ist, der drei [[Stickstoff]]­atome im sechsgliedrigen Ringsystem enthält. |
|||
Die [[Substituent|unsubstituierten]] Stammverbindungen haben nur eine geringe Bedeutung. Von den substituierten [[Derivat (Chemie)|Derivaten]] kommt den symmetrischen 1,3,5-Triazinen, bei denen der Sechsring aus jeweils drei abwechselnd angeordneten [[Kohlenstoff]]- und Stickstoffatomen besteht, vor allem als vielseitige Bausteine für weitere [[Synthese (Chemie)|Synthesen]] Bedeutung zu. |
|||
Als '''Triazine''' wird eine [[Stoffklasse]] chemischer Verbindungen bezeichnet, deren Grundstruktur ein [[aromat]]ischer [[Heterocyclen|Heterocyclus]] ist. |
|||
Die meisten Triazine sind 1,3,5-Triazine, bei denen der Sechsring aus jeweils drei abwechselnd angeordneten [[Kohlenstoff]]- und [[Stickstoff]]atomen besteht. |
|||
== Geschichte == |
|||
Mehrere Triazine, wie [[Atrazin]] und [[Simazin]], waren als wirksame [[Herbizide]] vor allem im Maisanbau weit verbreitet, sind aber heute aufgrund ihrer grundwassergefährdenden [[Persistenz (Chemie)|Persistenz]] in der [[EU]] verboten. Das Umweltverhalten ([[Bioakkumulation]], [[Adsorption]], [[Toxizität]]) ist je nach chemischer Struktur und Seitenkette stark unterschiedlich<ref>R. Kornmayer, B. Streit: ''Adsorption und Anreicherung von Atrazin und seinen Abbauprodukten an Flußwassersediment''. Arch. Hydrobiol./ Suppl. 55: 186-210 (1978).</ref><ref>B. Streit: ''Uptake, accumulation and release of organic pesticides by benthic invertebrates. 3. Distribution of <sup>14</sup>C-atrazine and <sup>14</sup>C-lindane in an experimental 3-step food chain microcosm''. Arch. Hydrobiol./ Suppl. 55: 374-400 (1979).</ref>. |
|||
Das erste kommerziell genutzte Triazin war das [[Fungizid]] [[Anilazin]] (1953).<ref>{{Patent | Land = US | V-Nr = 2720480 | Typ = Erteilung | Titel = Fungicidal compositions and method of using same | A-Datum = 1953-07-17 | V-Datum = 1955-10-11 | Erfinder = Calvin N. Wolf | Anmelder = Ethyl Corp. | DB=Google}}</ref> Darauf folgten die Triazin-[[Herbizid]]e aus der Gruppe der Chlordiaminotriazine, die 1954 von [[J. R. Geigy]] (heute: [[Novartis]]) zum Patent angemeldet wurden.<ref>{{Patent| Land = US| V-Nr = 2891855| Typ = Erteilung| Titel = Compositions and methods for influencing the growth of plants| A-Datum = 1955-01-12| V-Datum = 1959-06-23| Erfinder = Enrico Knusli| Anmelder = J. R. Geigy AG| DB = Google}}</ref> |
|||
Später kamen die Methylmercaptodiaminotriazine (Triatryne) und die Methoxydiaminotriazine (Triatone) dazu. |
|||
Auch zahlreiche andere bedeutsame chemische Zwischenprodukte enthalten die Triazinstruktur. So verwendet man zum Beispiel beim Färben mit [[Reaktivfärbung|Reaktivfarbstoffen]] chlorierte Triazine als "reaktive Anker": Der Farbstoff wird an den Triazinring gebunden, der dann mit der OH-Gruppe einer Zellulosefaser (Baumwolle) reagiert (unter HCl-Abspaltung). Dabei wird der Farbstoff über eine [[Atombindung]] fest an den Baumwollfaden gebunden, was eine hohe Waschechtheit hervorruft. |
|||
== |
== Eigenschaften == |
||
Das cyclische Trimer der [[Blausäure]] 1,3,5-Triazin zersetzt sich erst oberhalb von 600 °C in Blausäure, [[Stickstoff]] und [[Kohlendioxid]].<ref name="Roth_Weller">L. Roth, U. Weller: ''Gefährliche Chemische Reaktionen'', Eintrag für 1,3,5-Triazin, Stand 72. Ergänzungslieferung 3/2014, ecomed Verlag Landsberg/Lech, ISBN 978-3609195872.</ref> |
|||
== Verwendung == |
|||
Mehrere Triazine, wie [[Atrazin]] und [[Simazin]], waren als wirksame Herbizide vor allem im Maisanbau weit verbreitet, sind aber heute aufgrund ihrer grundwassergefährdenden [[Persistenz (Chemie)|Persistenz]] in der [[EU]] verboten. Das Umweltverhalten ([[Bioakkumulation]], [[Adsorption]], [[Toxizität]]) ist je nach chemischer Struktur und Seitenkette stark unterschiedlich.<ref>R. Kornmayer, B. Streit: [https://www.researchgate.net/publication/235695196_Adsorption_und_Anreicherung_von_Atrazin_und_seinen_Abbauprodukten_an_Flusswassersediment ''Adsorption und Anreicherung von Atrazin und seinen Abbauprodukten an Flußwassersediment'']. In: ''Arch. Hydrobiol.'' Suppl. 55, 1978. S. 186–210.</ref><ref>B. Streit: ''Uptake, accumulation and release of organic pesticides by benthic invertebrates. 3. Distribution of <sup>14</sup>C-atrazine and <sup>14</sup>C-lindane in an experimental 3-step food chain microcosm''. Arch. Hydrobiol./ Suppl. 55: 374–400 (1979).</ref> |
|||
Auch zahlreiche andere bedeutsame chemische Zwischenprodukte enthalten die Triazinstruktur. So enthalten zum Beispiel viele [[Reaktivfarbstoffe]] chlor- oder fluorsubstituierte Triazine als „reaktive Anker“: Der Chromophor wird an den Triazinring gebunden, der dann beim Färbeprozess unter alkalischen Bedingungen mit einer OH-Gruppe der [[Cellulose]] (Baumwolle) unter HCl-Abspaltung reagiert. Dabei wird der Farbstoff über eine [[kovalente Bindung|kovalente chemische Bindung]] an die Baumwollfaser gebunden, woraus eine hohe Waschechtheit resultiert. |
|||
== Derivate (Auswahl) == |
|||
[[Datei:Simazine Structural Formulae .V.1.svg|mini|Simazin, ein Chlordiaminotriazin]] |
|||
[[Datei:Ametryn v2.svg|mini|Ametryn, ein Triatryn]] |
|||
[[Datei:Terbumetone Structural Formula V.1.svg|mini|Terbumeton, ein Triaton]] |
|||
* [[6-Methyl-1,3,5-triazin-2,4-diyldiamin|Acetoguanamin]] |
|||
* [[Atrazin]] |
* [[Atrazin]] |
||
* [[ |
* [[Cyanazin]] |
||
* [[Cyanurchlorid]] |
* [[Cyanurchlorid]] |
||
* [[Cyanurfluorid]] |
|||
* [[Cyanursäure]] |
* [[Cyanursäure]] |
||
* [[Cyanurtriazid]] |
|||
* [[Cybutryn]] |
|||
* [[Desmetryn]] |
|||
* [[Prometon]] |
|||
* [[Prometryn]] |
|||
* [[Propazin]] |
|||
* [[Simazin]] |
|||
* [[Terbumeton]] |
|||
* [[Terbuthylazin]] |
* [[Terbuthylazin]] |
||
* [[Terbutryn]] |
|||
* [[Trisbiphenyltriazin]]e |
|||
* [[Melamin]] |
* [[Melamin]] |
||
* [[Irgarol]] |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
<references/> |
<references /> |
||
{{Normdaten|TYP=s|GND=4186035-4}} |
|||
[[Kategorie:Stoffgruppe]] |
[[Kategorie:Stoffgruppe]] |
||
[[Kategorie:Triazin| Tria]] |
[[Kategorie:Triazin| Tria]] |
||
[[Kategorie:Feldwirtschaft]] |
|||
[[cs:Triazin]] |
|||
[[en:Triazine]] |
|||
[[es:Triazina]] |
|||
[[fi:Triatsiini]] |
|||
[[fr:Triazine]] |
|||
[[id:Triazina]] |
|||
[[ja:トリアジン]] |
|||
[[pl:Triazyny]] |
|||
[[ru:Триазины]] |
|||
[[zh:三嗪]] |
|||
Aktuelle Version vom 1. August 2024, 17:15 Uhr
| Triazine | |||||||
| Name | 1,2,3-Triazin | 1,2,4-Triazin | 1,3,5-Triazin | ||||
| Andere Namen | v-Triazin vic-Triazin |
as-Triazin asym-Triazin |
s-Triazin sym-Triazin | ||||
| Strukturformel |  |
 |
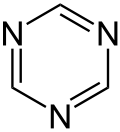
| ||||
| CAS-Nummer | 289-96-3 | 290-38-0 | 290-87-9 | ||||
| EG-Nummer | 808-989-8 | 206-028-1 | |||||
| ECHA-Infocard | 100.236.897 | 100.005.481 | |||||
| PubChem | 123047 | 67520 | 9262 | ||||
| Wikidata | Q27117364 | Q27117363 | Q751744 | ||||
| Summenformel | C3H3N3 | ||||||
| Molare Masse | 81,08 g·mol−1 | ||||||
| Aggregatzustand | fest | flüssig | fest | ||||
| Kurzbeschreibung | blassgelbes Öl[1] | farblose, stark lichtbrechende, rhomboedrische Kristalle[1] | |||||
| Schmelzpunkt | 70 °C[2] | 17 °C[1] | 86 °C[1] | ||||
| Siedepunkt | 156 °C[1] | 114 °C[1] | |||||
| Dichte | 1,448 g·cm−3[2] | 1,38 g·cm−3[1] | |||||
| Löslichkeit | löslich in Ethanol, Diethylether; Zersetzung in Wasser[1] | ||||||
| GHS- Kennzeichnung |
Achtung[3] |
|
Gefahr[4] | ||||
| H- und P-Sätze | 302‐315‐319‐335 | siehe oben | 302‐315‐318‐335 | ||||
| ? | siehe oben | 261‐280‐305+351+338 | |||||
Als Triazine wird eine Gruppe chemischer Verbindungen bezeichnet, deren Grundstruktur ein aromatischer Heterocyclus ist, der drei Stickstoffatome im sechsgliedrigen Ringsystem enthält.
Die unsubstituierten Stammverbindungen haben nur eine geringe Bedeutung. Von den substituierten Derivaten kommt den symmetrischen 1,3,5-Triazinen, bei denen der Sechsring aus jeweils drei abwechselnd angeordneten Kohlenstoff- und Stickstoffatomen besteht, vor allem als vielseitige Bausteine für weitere Synthesen Bedeutung zu.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Das erste kommerziell genutzte Triazin war das Fungizid Anilazin (1953).[5] Darauf folgten die Triazin-Herbizide aus der Gruppe der Chlordiaminotriazine, die 1954 von J. R. Geigy (heute: Novartis) zum Patent angemeldet wurden.[6]
Später kamen die Methylmercaptodiaminotriazine (Triatryne) und die Methoxydiaminotriazine (Triatone) dazu.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Das cyclische Trimer der Blausäure 1,3,5-Triazin zersetzt sich erst oberhalb von 600 °C in Blausäure, Stickstoff und Kohlendioxid.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Mehrere Triazine, wie Atrazin und Simazin, waren als wirksame Herbizide vor allem im Maisanbau weit verbreitet, sind aber heute aufgrund ihrer grundwassergefährdenden Persistenz in der EU verboten. Das Umweltverhalten (Bioakkumulation, Adsorption, Toxizität) ist je nach chemischer Struktur und Seitenkette stark unterschiedlich.[8][9]
Auch zahlreiche andere bedeutsame chemische Zwischenprodukte enthalten die Triazinstruktur. So enthalten zum Beispiel viele Reaktivfarbstoffe chlor- oder fluorsubstituierte Triazine als „reaktive Anker“: Der Chromophor wird an den Triazinring gebunden, der dann beim Färbeprozess unter alkalischen Bedingungen mit einer OH-Gruppe der Cellulose (Baumwolle) unter HCl-Abspaltung reagiert. Dabei wird der Farbstoff über eine kovalente chemische Bindung an die Baumwollfaser gebunden, woraus eine hohe Waschechtheit resultiert.
Derivate (Auswahl)
[Bearbeiten | Quelltext bearbeiten]


- Acetoguanamin
- Atrazin
- Cyanazin
- Cyanurchlorid
- Cyanurfluorid
- Cyanursäure
- Cyanurtriazid
- Cybutryn
- Desmetryn
- Prometon
- Prometryn
- Propazin
- Simazin
- Terbumeton
- Terbuthylazin
- Terbutryn
- Trisbiphenyltriazine
- Melamin
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Triazine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. März 2014.
- ↑ a b Neunhoeffer, H.; Clausen, M.; Voetter, H.–D.; Ohl, H.; Krueger, C.; Angermund, K.: 1,2,3‐Triazine, III Synthese von N‐Aminopyrazolen und deren Oxidation zu 1,2,3‐Triazinen. Molekülstruktur des 1,2,3‐Triazins in Liebigs Ann. Chem. 1985, 1732–1751, doi:10.1002/jlac.198519850903.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1,2,3-Triazin im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. Juli 2016.
- ↑ Datenblatt s-Triazine, 97% bei Sigma-Aldrich, abgerufen am 6. November 2013 (PDF).
- ↑ Patent US2720480: Fungicidal compositions and method of using same. Angemeldet am 17. Juli 1953, veröffentlicht am 11. Oktober 1955, Anmelder: Ethyl Corp., Erfinder: Calvin N. Wolf.
- ↑ Patent US2891855: Compositions and methods for influencing the growth of plants. Angemeldet am 12. Januar 1955, veröffentlicht am 23. Juni 1959, Anmelder: J. R. Geigy AG, Erfinder: Enrico Knusli.
- ↑ L. Roth, U. Weller: Gefährliche Chemische Reaktionen, Eintrag für 1,3,5-Triazin, Stand 72. Ergänzungslieferung 3/2014, ecomed Verlag Landsberg/Lech, ISBN 978-3609195872.
- ↑ R. Kornmayer, B. Streit: Adsorption und Anreicherung von Atrazin und seinen Abbauprodukten an Flußwassersediment. In: Arch. Hydrobiol. Suppl. 55, 1978. S. 186–210.
- ↑ B. Streit: Uptake, accumulation and release of organic pesticides by benthic invertebrates. 3. Distribution of 14C-atrazine and 14C-lindane in an experimental 3-step food chain microcosm. Arch. Hydrobiol./ Suppl. 55: 374–400 (1979).

