Las coenzimas
- 1. Las coenzimas Las coenzimas son pequeñas moléculas orgánicas no proteicas que transportan grupos químicos entre enzimas. A veces se denominan cosustratos. Estas moléculas son sustratos de las enzimas y no forman parte permanente de la estructura enzimática. Esto distingue a las coenzimas de los grupos prostéticos, que son componentes no protéicos que se enlazan estrechamente a las enzimas, tales como los centros hierro-azufre, la flavina o los grupos hemo. Tanto coenzimas como grupos prostéticos pertenecen a un grupo más amplio, los cofactores, que son moléculas no protéicas (por lo general, moléculas orgánicas o iones metálicos) que requieren las enzimas para su actividad. En el metabolismo, las coenzimas están involucradas en reacciones de transferencia de grupos (como la coenzima A y la adenosina trifosfato (ATP)), y las reacciones redox (como la coenzima Q10 y la nicotinamida adenina dinucleótido (NAD+)). Las coenzimas se consumen y se reciclan continuamente en el metabolismo; un conjunto de enzimas añade un grupo químico a la coenzima y otro conjunto de enzimas lo extrae. Por ejemplo, las enzimas como la ATP sintasa fosforilan continuamente la adenosina difosfato (ADP), convirtiéndola en ATP, mientras que enzimas como las quinasas desfosforilan el ATP y lo convierten de nuevo en ADP. Las moléculas de coenzima son a menudo vitaminas o se hacen a partir de vitaminas. Muchas coenzimas contienen el nucleótido adenosina como parte de su estructura, como el ATP, la coenzima A y el NAD+. Esta estructura común puede reflejar un origen evolutivo como parte de los ribozimas en un antiguo mundo de ARN.
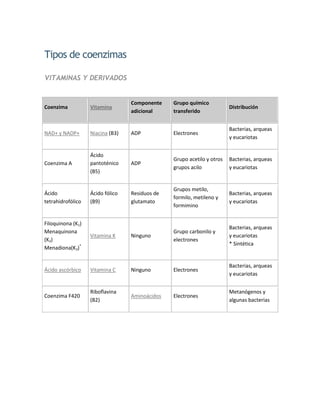
- 2. Tipos de coenzimas VITAMINAS Y DERIVADOS Componente Grupo químico Coenzima Vitamina Distribución adicional transferido Bacterias, arqueas NAD+ y NADP+ Niacina (B3) ADP Electrones y eucariotas Ácido Grupo acetilo y otros Bacterias, arqueas Coenzima A pantoténico ADP grupos acilo y eucariotas (B5) Grupos metilo, Ácido Ácido fólico Residuos de Bacterias, arqueas formilo, metileno y tetrahidrofólico (B9) glutamato y eucariotas formimino Filoquinona (K1) Bacterias, arqueas Menaquinona Grupo carbonilo y Vitamina K Ninguno y eucariotas (K2) electrones * Sintética Menadiona(K3)* Bacterias, arqueas Ácido ascórbico Vitamina C Ninguno Electrones y eucariotas Riboflavina Metanógenos y Coenzima F420 Aminoácidos Electrones (B2) algunas bacterias
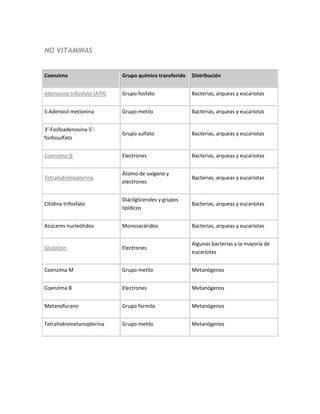
- 3. NO VITAMINAS Coenzima Grupo químico transferido Distribución Adenosina trifosfato (ATP) Grupo fosfato Bacterias, arqueas y eucariotas S-Adenosil metionina Grupo metilo Bacterias, arqueas y eucariotas 3'-Fosfoadenosina-5'- Grupo sulfato Bacterias, arqueas y eucariotas fosfosulfato Coenzima Q Electrones Bacterias, arqueas y eucariotas Átomo de oxígeno y Tetrahidrobiopterina Bacterias, arqueas y eucariotas electrones Diacilgliceroles y grupos Citidina trifosfato Bacterias, arqueas y eucariotas lipídicos Azúcares nucleótidos Monosacáridos Bacterias, arqueas y eucariotas Algunas bacterias y la mayoría de Glutatión Electrones eucariotas Coenzima M Grupo metilo Metanógenos Coenzima B Electrones Metanógenos Metanofurano Grupo formilo Metanógenos Tetrahidrometanopterina Grupo metilo Metanógenos
- 4. Funciones de las coenzimas La principal función de las coenzimas es actuar como intermediarios metabólicos. Elmetabolismo conlleva una amplia gama de reacciones químicas, pero la mayoría corresponden a unos tipos básicos de reacciones que implican la transferencia de grupos funcionales. Esta química común permite a las células utilizar un pequeño conjunto de intermediarios metabólicos para transportar grupos químicos entre las diferentes reacciones . Estos intermediarios en la transferencia de grupos son las coenzimas. Cada clase de reacción de transferencia de grupo se lleva a cabo por una coenzima particular, que es el sustrato de un conjunto de enzimas que la producen, y un conjunto de enzimas que la consumen. Un ejemplo de esto son las deshidrogenasas, que utilizan la nicotinamida adenina dinucleótido (NADH) como cofactor. Aquí, cientos de enzimas diferentes eliminan los electrones de sus sustratos y reducen el NAD+ a NADH. Esta coenzima reducida es entonces un sustrato para cualquiera de las reductasas presentes en la célula que necesitan reducir sus sustratos. Las coenzimas se reciclan continuamente, por lo tanto, como parte del metabolismo. A modo de ejemplo, la cantidad total de ATP en el cuerpo humano es aproximadamente 0,1 moles. Este ATP se ve constantemente degradado en ADP, y luego se convierte de nuevo en ATP. Así, en un momento determinado, el importe total de ATP más ADP se mantiene relativamente constante. La energía utilizada por las células humanas requiere la hidrólisis de 100 a 150 moles de ATP diario que es alrededor de 50 a 75 kg. Típicamente, un ser humano usará su peso corporal de ATP en el transcurso del día. Esto significa que cada molécula de ATP se recicla de 1000 a 1500 veces al día. El principal papel de las vitaminas es actuar como coenzimas en el organismo, aunque las vitaminas tienen otras funciones en el cuerpo. Las coenzimas también se fabrican a partir de nucleótidos, como la adenosina trifosfato (que es el transportador bioquímico de los grupos fosfato), o la coenzima A (que transporta grupos acilo). La mayoría de las coenzimas se encuentran en una enorme variedad de especies, y algunas son universales para todas las formas de vida. Una excepción a esta amplia distribución es un grupo único de coenzimas que evolucionaron en metanógenas, y que se limitan al grupo de las arqueas.
- 5. Coenzimas NAD+ y NADH La nicotinamida adenina dinucleótido (abreviado NAD+, y también llamada difosfopiridina nucleótido y Coenzima I), es una coenzima que se encuentra en todas las células vivas. El compuesto es un dinucleótido, ya que consta de dos nucleótidos unidos a través de sus grupos fosfato con un nucleótido que contiene un anillo adenosina y el otro que contiene nicotinamida. En el metabolismo, el NAD+ participa en las reacciones redox (oxidorreducción), llevando los electrones de una reacción a otra. La coenzima, por tanto, se encuentra en dos formas en las células: NAD+ y NADH. El NAD+, que es un agente oxidante, acepta electrones de otras moléculas y pasa a ser reducido, formándose NADH, que Coenzima NAD puede ser utilizado entonces como agente reductor para donar electrones. Estas reacciones de transferencia de electrones son la principal función del NAD+. Sin embargo, también es utilizado en otros procesos celulares, en especial como sustrato de las enzimas que añaden o eliminan grupos químicos de las proteínas, en modificaciones post-traduccionales. Debido a la importancia de estas funciones, las enzimas que intervienen en el metabolismo del NAD+ son objetivos para el descubrimiento de medicamentos. En los organismos, el NAD+ puede ser sintetizado desde cero (de novo) a partir de losaminoácidos triptófano o ácido aspártico. Alternativamente, los componentes de las coenzimas se obtienen a partir de los alimentos, como la vitamina llamada niacina. Compuestos similares son liberados por las reacciones que descomponen la estructura del NAD+. Estos componentes preformados pasan luego a través de una ruta que los recicla de vuelta a la forma activa. Algunos NAD+ también se convierten en nicotinamida adenina dinucleótido fosfato (NADP+), cuya química es similar a la de la coenzima NAD+, aunque tiene diferentes funciones en el metabolismo. BIOSÍNTESIS El NAD+ se sintetiza a través de dos rutas metabólicas: en una ruta de novo a partir de aminoácidos, o en rutas de rescate mediante el reciclado de componentes preformados como nicotinamida convertida de nuevo a NAD+.
- 6. Producción de novo La mayoría de los organismos sintetizan NAD+ a partir de componentes simples. El conjunto específico de reacciones varía entre los organismos, pero una característica común es la generación de ácido quinolínico (QA) a partir de un aminoácido, ya sea triptófano (Trp) en los Algunas rutas metabólicas que sintetizan y consumen NAD+ en los vertebrados. Las abreviaturas se definen en el texto. animales y algunas bacterias, o bien ácido aspártico en algunas bacterias y plantas. El ácido quinolínico se convierte en ácido nicotínico mononucleótido (NaMN) mediante transferencia de un grupo fosforibosa. Un grupo adenilato se transfiere entonces para formar ácido nicotínico adenina dinucleótido (NaAD). Por último, el grupo ácido nicotínico del NaAD es amidado a un grupo nicotinamida (Nam), formando nicotinamida adenina dinucleótido. En un nuevo paso, algunos NAD+ se convierten en NADP+ mediante la NAD+ kinasa, que fosforila el NAD+. En la mayoría de los organismos, esta enzima utiliza ATP como fuente del grupo fosfato, aunque en las bacterias tales como Mycobacterium tuberculosis y en las arqueas comoPyrococcus horikoshii, el polifosfato inorgánico es una alternativa como donante de fosfato. FUNCIONES La nicotinamida adenina dinucleótido tiene varias funciones esenciales en el metabolismo. Actúa como coenzima en las reacciones redox, como donante de grupos ADP-ribosa en las reacciones de ADP-ribosilación, como precursor del segundo mensajero de la molécula cíclica de ADP-ribosa, así como sustrato para las ADN ligasas bacterianas y un grupo de enzimas llamadas sirtuinas, que usan NAD+ para eliminar los grupos proteícos acetilo. Oxidoreductasas La principal función del NAD+ en el metabolismo es la transferencia de electrones de una reacción redox a otra. Este tipo de reacción es catalizada por un gran grupo de enzimas llamadas oxidoreductasas. Los nombres correctos para estas enzimas contienen los nombres de sus sustratos: por ejemplo, la NADH-ubiquinona
- 7. oxidoreductasa cataliza la oxidación del NADH por la coenzima Q. Sin embargo, estas enzimas son también conocidas como deshidrogenasas o reductasas, por lo que la NADH-ubiquinona oxidoreductasa también suele ser llamada NADH deshidrogenasa o, a veces, coenzima Q reductasa. Cuando están enlazados a una proteína, el NAD+ y el NADH suelen mantenerse en un motivo estructural conocido como pliegue Rossmann. El nombre proviene de Michael Rossmann, que fue el primer científico en darse cuenta de lo común que es esta estructura dentro de las proteínas enlazadas a nucleótidos. Este pliegue contiene tres o más hebras beta paralelas enlazadas mediante dos hélices alfa en el orden beta-alfa-beta-alfa- beta. Esto forma una hoja beta flanqueada por una capa de hélices alfa a cada lado. Debido a que cada pliegue Rossmann enlaza un nucleótido, los dominios de enlace para el dinucleótido NAD+ consisten de dos pares de El pliegue de Rossmann en la zona de la lactato pliegues Rossmann, con cada pliegue deshidrogenasa de Cryptosporidium parvum, con el NAD+ en rojo, las láminas beta en amarillo enlazando un nucleótido dentro del cofactor. y las hélices alfa en púrpura. Sin embargo, este pliegue no es universal entre las enzimas dependientes de NAD, ya que se ha descubierto recientemente que una clase de enzimas bacterianas involucradas en el metabolismo de los aminoácidos se enlazan a la coenzima pero carecen de esta forma de pliegue. Cuando se enlaza al sitio activo de una oxidoreductasa, el anillo nicotinamida de la coenzima se coloca de modo que pueda aceptar un hidruro del otro sustrato. Ya que el carbono C4 que acepta el hidrógeno es proquiral, esto puede ser explotado en la cinética de enzimas para dar información sobre el mecanismo enzimático. Esto se hace mediante la mezcla de una enzima con un sustrato que tiene átomos de deuterio sustituidos por los hidrógenos, de tal forma que la enzima reducirá el NAD+ mediante la transferencia de un deuterio en lugar de un átomo de hidrógeno. En este caso, una enzima puede producir uno de los dos estereoisómeros de NADH. En algunas enzimas, el hidrógeno se transfiere desde el plano superior del anillo de nicotinamida (las oxidoreductasas clase A), mientras que en otras enzimas (las oxidoreductasas de clase B) la transferencia se produce desde abajo.
- 8. A pesar de esta similitud en la forma en que las proteínas se unen a las coenzimas, las enzimas casi siempre muestran un alto nivel de especificidad, ya sea por el NAD+ o el NADP+. Esta especificidad refleja las distintas funciones metabólicas de las dos coenzimas, y es el resultado de diferentes clases de residuos de aminoácidos en los dos tipos de sitios de unión al coenzima. Por ejemplo, en el sitio activo de las enzimas Aspecto del NAD en 3D. dependientes de ADP, se forma un enlace iónico entre una cadena lateral de aminoácidos básico y el grupo fosfato ácido del NADP+. Por el contrario, en las enzimas dependientes de NAD, la carga en este bolsillo se invierte, impidiendo el enlace del NADP+. Sin embargo, hay algunas excepciones a esta regla general, y enzimas como la aldosa reductasa, glucosa-6-fosfato deshidrogenasa, y la metilentetrahidrofolato reductasa pueden utilizar ambas coenzimas en algunas especies. Papel en el metabolismo redox Las reacciones redox catalizadas por oxidoreductasas son vitales en todo el metabolismo, pero una esfera particularmente importante es la liberación de energía de los nutrientes. Los compuestos reducidos, como laglucosa, se oxidan, liberando así la energía. Esta energía se transfiere al NAD+ mediante reducción a NADH, como parte de la glucolisis y el ciclo del ácido cítrico (ciclo de Krebs). En eucariotas, los electrones transportados por el NADH que se produce en el citoplasma mediante glucolisis son transferidos al Esquema del metabolismo redox interior de la mitocondria por lanzaderas mitocondriales, como la lanzadera malato- aspartato. El NADH es oxidado a su vez por la cadena de transporte de electrones, que bombea protones a través de la membrana y genera ATP a través de la fosforilación oxidativa. Estos sistemas de lanzadera también tienen la misma función de transporte en los cloroplastos. Dado que tanto las formas oxidadas como reducidas de nicotinamida adenina dinucleótido se utilizan en estos conjuntos de reacciones enlazadas, la célula mantiene aproximadamente concentraciones iguales de NAD+ y NADH. Una
- 9. proporción alta de NAD+/NADH permite a este coenzima actuar como agente oxidante y como reductor. En contraste, la función principal del NADP+ es como agente reductor en el anabolismo, estando la coenzima implicada en rutas como la síntesis de ácidos grasos y la fotosíntesis. Dado que el NADPH es necesario para conducir las reacciones redox como un fuerte agente reductor, la proporción NADP+/NADPH se mantiene muy baja. Aunque es importante en el catabolismo, el NADH se utiliza también en las reacciones anabólicas, como la gluconeogénesis. Esta necesidad de NADH en el anabolismo plantea un problema creciente para los procariotas que crecen en nutrientes que liberan sólo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, lo que libera energía suficiente para bombear los protones y generar ATP, pero no la suficiente como para producir NADH directamente. Como el NADH sigue siendo necesario para las reacciones anabólicas, estas bacterias utilizan una nitrito oxidoreductasa para producir la suficiente fuerza motriz de protones como para ejecutar parte de la cadena de transporte de electrones en sentido inverso, generando NADH. Funciones no redox La coenzima NAD+ se consume también en las reacciones de transferencia de ADP- ribosa. Por ejemplo, las enzimas llamadas ADP-ribosiltransferasas añaden la fracción ADP-ribosa de esta molécula a las proteínas, en una modificación postraduccional llamada ADP-ribosilación. Esta reacción implica la adición de un solo grupo ADP- ribosa (mono-ADP-ribosilación), o la transferencia de ADP-ribosa a las proteínas en cadenas largas ramificadas (poli-ADP-ribosilación). La mono-ADP-ribosilación se identificó por primera vez como el mecanismo de un grupo de toxinas bacterianas, en particular la toxina del cólera, pero también participan en la señalización celular normal. La poli-ADP-ribosilación es llevada a cabo por las polimerasas poli-(ADP- ribosa). La estructura de poli-(ADP-ribosa) está implicada en la regulación de varios eventos celulares, y es más importante en el núcleo celular, en procesos como la reparación del ADN o el mantenimiento del telómero mantenimiento. Además de estas funciones dentro de la célula, se ha descubierto recientemente un grupo de ADP-ribosiltransferasas extracelulares, pero sus funciones aún no están claras.
- 10. Otra función de esta coenzima en la señalización celular es como precursor de la ADP-ribosa cíclica, que se produce a partir de NAD+ por ADP-ribosil ciclasas, como parte de un sistema de segundo mensajero. Esta molécula actúa en la señalización de calcio mediante la liberación de calcio de las reservas intracelulares. Esto lo hace mediante el Estructura de la ADP-ribosa cíclica enlace y apertura de una clase de canales de calcio llamados receptores de rianodina, que se encuentran en las membranas de los orgánulos como el retículo endoplasmático. El NAD+ también es consumido por las sirtuinas, que son deacetilasas dependientes de NAD, como la Sir2. Estas enzimas actúan mediante la transferencia de un grupo acetilo de sus proteínas sustrato a la fracción ADP-ribosa del NAD+; esto rompe la coenzima y libera nicotinamida y O-acetil-ADP-ribosa. Las sirtuinas parecen estar implicadas en la regulación de la transcripción a través de histonas deacetilantes y alteración de la estructura del nucleosoma. Aunque las proteínas no histonas pueden ser desacetilizadas también por las sirtuinas. Esta actividad de las sirtuinas es especialmente interesante debido a su importancia en la regulación del envejecimiento. Otras enzimas dependientes de NAD son las ADN ligasas bacterianas, que unen dos extremos de ADN mediante el uso de NAD+ como sustrato para donar un grupo adenosina monofosfato (AMP) al fosfato 5' de un extremo de ADN. Este intermediario es atacado luego por el grupo hidroxilo 3' del otro extremo de ADN, formando un nuevo enlace fosfodiéster. Esto contrasta con las ADN ligasas eucarióticas, que utilizan el ATP para formar intermediarios ADN-AMP.
- 11. Coenzima A (CoA) La coenzima A (CoA) es una coenzima de transferencia de grupos acilo que participa en diversas rutas metabólicas (ciclo de Krebs, síntesis y oxidación deácidos grasos). Se deriva de una vitamina: el ácido pantoténico (vitamina B5), y es una coenzima libre. Su aislamiento se produjo en 1951 por el bioquímico alemán (y premio Nobel) Feodor Lynen, en forma de acetil-coenzima A a partir de células de levadura. Su parte reactiva es la función tiol (-SH) de la tioetanolamina, que se simboliza a menudo Coenzima A como HS-CoA (o CoA-SH). Por lo tanto, la reacción con un ácido carboxílico forma un enlace aciltioéster rico en energía. Fuentes alimenticias de esta coenzima son: despojos, setas, carne y yema de huevo. Reacción: CoA-SH + R-COOH => S-CoA-CO-R (+ H2O) BIOSÍNTESIS La molécula de coenzima A consta de varios componentes: un nucleótido (adenosina difosfato, ADP), una vitamina (ácido pantoténico, vitamina B5) y un aminoácido (cisteína). Se sintetiza en un proceso de cinco etapas a partir del pantotenato: 1. El pantotenato se fosforila a 4'-fosfopantotenato mediante la enzima pantotenato kinasa. 2. Una cisteína es añadida al 4'-fosfopantotenato mediante la enzima fosfopantotenoilcisteína sintetasa, para formar 4'-fosfo-N-pantotenoilcisteína (PPC). 3. La PPC se descarboxila a 4'-fosfo-panteteína mediante la fosfopantotenoilcisteína descarboxilasa. 4. La 4'-fosfo-panteteína es adenililada para formar defosfo-CoA mediante la enzima fosfopanteteína adenilil transferasa. 5. Por último, la defosfo-CoA es fosforilada a CoA (coenzima A) utilizando ATP, mediante la enzima defosfo-CoA kinasa.
- 12. FUNCIÓN Puesto que la coenzima A es químicamente un tiol, puede reaccionar con los ácidos carboxílicos para formar tioésteres, funcionando así como un transportador de grupos acilo. Asiste en la transferencia de ácidos grasos desde el citoplasma a las mitocondrias. Una molécula de coenzima A que transporta un grupo acetilo se conoce como acetil-CoA. Cuando no lleva grupo acilo generalmente se denomina CoASH o HSCoA. Grupos acilo transportados por el Coenzima A * Acetil-CoA * Propionil-CoA * Acetoacetil-CoA * Cumaril-CoA (utilizado en la biosíntesis de flavonoides) * Derivados acilo de ácidos dicarboxílicos: o Malonil-CoA o Succinil-CoA o Hidroximetilglutaril-CoA (utilizado en la biosíntesis de isoprenoides) o Pimelil-CoA (utilizado en la biosíntesis de biotina) * Butiril-CoA Adenosina trifosfato (ATP) La adenosina trifosfato (abreviado ATP, y también llamada adenosín-5'-trifosfato o trifosfato de adenosina) es una molécula utilizada por todos los organismos vivos para proporcionar energía en las reacciones químicas. También es el precursor de una serie de coenzimas esenciales como el NAD+ o la coenzima A. El ATP es uno de los cuatro Fórmula estructural del ATP monómeros utilizados en la síntesis de ARN celular. Además, es una coenzima de transferencia de grupos fosfato que se enlaza de manera no-covalente a las enzimas quinasas (co-sustrato). El ATP fue descubierto en 1929 por Karl Lohmann. En 1941, Fritz Albert Lipmann propuso el ATP como principal molécula de transferencia de energía en la célula.
- 13. PROPIEDADES Y ESTRUCTURA El ATP es un nucleótido trifosfato que se compone de adenosina (adenina y ribosa, como β-D-ribofuranosa) y tres grupos fosfato. Su fórmula molecular es C10H16N5O13P3. La estructura de la molécula consiste en una base purina (adenina) enlazada al átomo de carbono 1' de un azúcar pentosa. Los tres grupos fosfato se enlazan al átomo de carbono 5' de la pentosa. Los grupos fosforilo, comenzando con el grupo más cercano a la ribosa, se conocen como fosfatos alfa (α), beta (β) y gamma (γ). Estructura en 3D del ATP El ATP es altamente soluble en agua y muy estable en soluciones de pH entre 6.8 y 7.4, pero se hidroliza rápidamente a pH extremo. Por consiguiente, se almacena mejor como una sal anhidra. La masa molecular del ATP es de 507,181 g/mol y su acidez es de 6.5. Es una molécula inestable y tiende a ser hidrolizada en el agua. Si el ATP y el ADP se encuentran en equilibrio químico, casi todos los ATP se convertirán a ADP. Las células mantienen la proporción de ATP a ADP en el punto de diez órdenes de magnitud del equilibrio, siendo las concentraciones de ATP miles de veces superior a la concentración de ADP. Este desplazamiento del equilibrio significa que la hidrólisis de ATP en la célula libera una gran cantidad de energía. Al ATP se le llama a veces "molécula de alta energía", aunque esto no es correcto, ya que una mezcla de ATP y ADP en equilibrio en el agua no puede hacer un trabajo útil. El ATP no contiene "enlaces de alta energía", y cualquier otra molécula inestable serviría como una forma de almacenar energía si la célula mantuviera su concentración lejos del equilibrio. El ATP tiene múltiples grupos ionizables con diferentes constantes de disociación del ácido. En solución neutra, el ATP está ionizado y existe principalmente como ATP4-, con una pequeña proporción de ATP3-. Como tiene varios grupos cargados negativamente en solución neutra, puede quelar metales con una afinidad muy elevada. El ATP existe en la mayoría de las células en un complejo con Mg2+.
- 14. FUNCIONES Fuente de energía El ATP es la principal fuente de energía para la mayoría de las funciones celulares. Esto incluye la síntesis de macromoléculas como el ADN, el ARN y las proteínas. También desempeña un papel fundamental en el transporte de macromoléculas a través de las membranas celulares, es decir, en la exocitosis y endocitosis. Debido a la presencia de enlaces ricos en energía (entre los grupos fosfato son los enlaces anhídrido del ácido), esta molécula se utiliza en los seres vivos para proporcionar la energía que se consume en las reacciones químicas. De hecho, la reacción de hidrólisis de la adenosina trifosfato en adenosina difosfato y fosfato es una reacción exergónica donde la variación de entalpía libre estándar es igual a - 30,5 kJ/mol: Por el contrario, la reacción de síntesis de la adenosina trifosfato a partir de adenosina difosfato y fosfato es una reacción endergónica donde la variación de entalpía libre estándar es igual a +30,5 kJ/mol: La reacción de hidrólisis del ATP en adenosín monofosfato (y pirofosfato) es una reacción exergónica donde la variación de entalpía libre estándar es igual a -42 kJ/mol: La energía se almacena en los enlaces entre los grupos fosfato. Sin embargo, hay un nivel de entalpía a sobrepasar antes de liberar esta energía (estado de transición). Esto explica por qué la hidrólisis de los enlaces pirofosfato no sucede todo el tiempo. Las enzimas son capaces de reducir ese umbral de entalpía para utilizar la energía liberada. Si la energía se almacena en los enlaces anhídridos, podríamos preguntarnos cuál es el interés de los seres vivos para sintetizar la molécula en su conjunto y no sólo el pirofosfato libre. La razón es, probablemente, la capacidad de las enzimas para reconocer el ATP, más fácil de hidrolizar específicamente que los pirofosfatos libres, que son muy similares a todos los grupos fosfatos presentes en las biomoléculas.
- 15. El ADP puede ser fosforilado por la cadena respiratoria de las mitocondrias y los procariotas, o por los cloroplastos de las plantas, para restaurar el ATP. La coenzima ATP/ADP es un proveedor de energía universal, y es la principal fuente de energía directamente utilizable por la célula. En los seres humanos, el ATP constituye la única energía utilizable por el músculo. En la síntesis del ácido nucleico ARN, el ATP es uno de los cuatro nucleótidos incorporados directamente en las moléculas por las enzimas ARN polimerasas. La energía que conduce esta polimerización procede de la ruptura del pirofosfato (dos grupos de fosfato). El proceso es similar en la biosíntesis de ADN, salvo que el ATP se reduce al desoxirribonucleótido dATP, antes de su incorporación en el ADN. El ATP está críticamente involucrado en el mantenimiento de la estructura celular, facilitando el montaje y desmontaje de elementos del citoesqueleto. En un proceso similar, el ATP es necesario para el acortamiento de los filamentos de actina y miosina necesarios para la contracción muscular. Este último proceso es una de las principales necesidades energéticas de los animales y es esencial para la locomoción y la respiración. Señalización extracelular El ATP, el ADP o la adenosina son reconocidos por los receptores purinérgicos. En los seres humanos, esta señalización tiene un importante papel tanto en el sistema nervioso central como en el periférico. La liberación de ATP de las sinapsis, los axones y la neuroglía activa los receptores de membrana purinéricos conocidos como P2. Los receptores P2Y son metabotrópicos, es decir, modulan el calcio intracelular y, a veces, los niveles de AMP cíclico. Señalización intracelular Es utilizado por las quinasas como la fuente de grupos fosfato en sus reacciones de transferencia de fosfato. La actividad de las quinasas sobre los sustratos como las proteínas o los lípidos de la membrana son una forma común de transducción de señales. La fosforilación de una proteína por una quinasa puede activar esta cascada. La adenilato ciclasa también usa el ATP y lo transforma en AMP cíclico (AMPc), una molécula segundo mensajero que está involucrada en el desencadenamiento de las señales de calcio mediante la liberación de calcio intracelular. Esta forma de transducción de señales es particularmente importante en la función cerebral, aunque está involucrada en la regulación de multitud de otros procesos celulares.
- 16. Síntesis de desoxirribonucleótidos En todos los organismos conocidos, los desoxirribonucleótidos que componen el ADN se sintetizan por la acción de enzimas ribonucleótido reductasas (RNR). Estas enzimas reducen el grupo hidroxilo 2' en el azúcar ribosa, que pasa a ser desoxirribosa, formando un desoxirribonucleótido (dATP). Todas las enzimas ribonucleótido reductasas usan un radical sulfidrilo común en un mecanismo de reacción que depende de los residuos cisteína, que se oxidan para formar enlaces disulfuro en el curso de la reacción. Las enzimas RNR son recicladas mediante reacción con tiorredoxina o glutaredoxina. ALMACENAMIENTO DE ATP Las reservas de ATP en el organismo no exceden de unos pocos segundos de consumo. En principio, el ATP se produce de forma continua, pero cualquier proceso que bloquee su producción provoca la muerte rápida (como es el caso de determinados gases de combate diseñados para tal fin; o venenos como el cianuro, que bloquean la cadena respiratoria; o el arsénico, que sustituye el fósforo y hace que sean inutilizables las moléculas fosfóricas). Las moléculas de creatina enlazan un fosfato mediante un enlace rico en energía como el ATP. El ADP puede convertirse en ATP por acoplamiento con la hidrólisis de fosfato de creatina. La creatina, por tanto, recicla el fosfato liberado por la hidrólisis de la molécula de ATP original. Esto ayuda a mantener la energía fácilmente movilizada sin agotar las reservas de ATP. El ATP no se puede almacenar en su estado natural, sino sólo como intermediarios de la cadena de producción de ATP. Por ejemplo, el glucógeno puede ser convertido en glucosa y aportar combustible a la glucolisis si el organismo necesita más ATP. El equivalente vegetal del glucógeno es el almidón. La energía puede también ser almacenada como grasa, mediante neo-síntesis de ácidos grasos. Ácido ascórbico El ácido ascórbico es un ácido de azúcar con propiedades antioxidantes. Su aspecto es de polvo o cristales de color blanco-amarillento. Es soluble en agua. El enantiómero L- del ácido ascórbico se conoce popularmente como vitamina C. El nombre "ascórbico" procede del prefijo a- (que significa "no") y de la
- 17. palabra latina scorbuticus (escorbuto), una enfermedad causada por la deficiencia de vitamina C. En 1937, Walter Haworth recibió el Premio Nobel de Química por su trabajo en la determinación de la estructura del ácido ascórbico (compartido con Paul Karrer, que recibió su premio por el trabajo con las vitaminas). Ese mismo año el premio de Fisiología y Medicina fue para Albert Szent-Györgyi por sus estudios de las funciones biológicas del ácido L- ascórbico. En el momento de su descubrimiento, en los años 20, fue llamado ácido hexurónico por algunos investigadores. La síntesis química del ácido L-ascórbico es un procedimiento caro y complicado que conlleva muchos pasos químicos que parten de la D-glucosa, y un único paso enzimático que implica a la sorbitol-deshidrogenasa. La última etapa del proceso es la transformación catalizada del ácido 2-ceto-L-gulónico (2-KGL) en ácido L- ascórbico. Se ha observado que, en la naturaleza, algunas bacterias como Acetobacter, Gluconbacter yErwinia, son capaces de transformar la glucosa en ácido 2,5-diceto-D-gulónico (2,5-DKG), mientras que otras, Corynebacterium, Brevibacterium y Arthrobacter, son capaces de transformar el ácido 2,5-DKG en ácido 2-KLG gracias a la enzima 2,5-DKG-reductasa. Gracias a la tecnología de ADN recombinante, ha sido posible aislar el gen de la 2,5- DKG-reductasa en la especie Corynebacterium y expresarlo en Erwinia berbicola, capaz de transformar la glucosa en 2,5-DKG gracias a tres enzimas. Las células de Erwiniatransformadas son capaces de convertir directamente la glucosa en ácido 2-KLG.