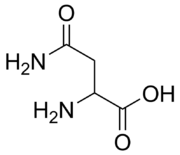
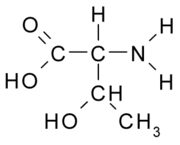
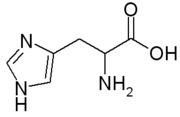
Aminoácido
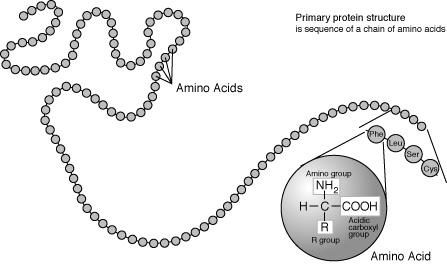
Aminoácidos são moléculas orgânicas que contém grupos funcionais amina e carboxila. Eles são os blocos de construção básicos usados para fazer proteínas, e são, portanto, um componente essencial dos organismos vivos. Há vinte aminoácidos diferentes que são utilizados para formar proteínas, que estão ligados juntos formando inicialmente cadeias chamadas peptídeos. Os peptídeos são então dobrados e reunidos a outros peptídeos para formar proteínas, que são as máquinas que executam os processos requeridos pela vida.[1]
Estrutura
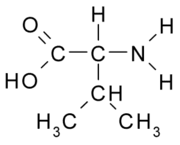
Todas as moléculas de aminoácidos têm um grupo amina (NH2 e um grupo carboxila (COOH) (mostrado à direita). Cada um dos aminoácidos individuais têm uma cadeia lateral única (designada pela letra R). A cadeia lateral é uma molécula que é ligada a uma estrutura central.
Os aminoácidos são agrupados de acordo com as propriedades das suas cadeias laterais, porque é a cadeia lateral que determina as propriedades da molécula. Alguns aminoácidos são ácidos fracos, bases fracas, hidrofílicos, polares, ou hidrofóbicos. [2]
Quiralidade
Os aminoácidos são moléculas quirais, o que significa que eles existem como isômeros ópticos uns dos outros. As duas formas são conhecidas como grupos D e L. Uma molécula "quiral" é aquela que não pode ser sobreposta a sua imagem no espelho. Assim como as mãos direita e esquerda são imagens de espelho e não as mesmas, as moléculas quirais tem as mesmas unidades ligadas na mesma ordem, mas, como imagens no espelho uma da outra.
Embora a maioria dos aminoácidos possa existir nas formas das mãos esquerda e direita, a vida na Terra é feita quase que exclusivamente só de aminoácidos canhotos. O grupo amino L está presente na maioria dos aminoácidos que são encontradas nas proteínas. O grupo amino D é encontrado apenas em algumas proteínas que são formadas por organismos exóticos que vivem no mar. Ninguém sabe por que este é o caso, mas isto oferece uma forte evidência de que a vida foi projetada e não o resultado de química aleatória evolução.
Classificação
Aminoácidos hidrófilos e hidrófobos
Um aminoácido hidrofílico ou hidrófilo é aquele que atrai água. O aminoácido hidrofílico tem cadeias laterais polares que formam ligações de hidrogénio fracas com água e outras substâncias polares ou carregadas. Um aminoácido hidrofóbico ou hidrófobo é aquele que é não carregado e não polar e tende a repelir a água. O aminoácido hidrofóbico tem uma cadeia lateral que é composta de hidrocarbonetos não-polares ou hidrocarbonetos modificados muito ligeiramente. Existem três diferentes cadeias laterais hidrofóbicas: cisteína, glicina e prolina. A cadeia lateral da cisteína pode reagir com outra cadeia de cisteína para formar uma ponte dissulfureto, a qual é uma ligação covalente. A cadeia lateral de glicina tem um único átomo de hidrogênio e é suficientemente pequena para caber em cantos apertados no interior de uma molécula de proteína. Ela irá caber em lugares que não acomodam uma cadeia maior. Uma cadeia lateral de prolina difere dos outros dois tipos na forma que possui um grupo amino modificado. Falta-lhe um hidrogênio em seu nitrogênio, o que limita a sua capacidade de ligação de hidrogênio. Os aminoácidos podem ser tanto hidrofílicos ou hidrofóbicos, até um certo grau. Isto depende da polaridade da cadeia lateral. Se o aminoácido é hidrofílica ou hidrofóbicos determina o quanto o aminoácido irá interagir com outras estruturas. Isto vai determinar a estrutura terciária da proteína. A localização na parte externa determina a estrutura quaternária. [3]
Essenciais e não essenciais
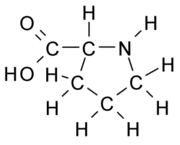
Dos vinte aminoácidos, alguns são chamados os aminoácidos essenciais, porque eles são necessários para a sobrevivência e não podem ser sintetizados de novo pelo organismo. Eles devem ser obtidos a partir de alimentos. Histidina e arginina são dois aminoácidos que são usados apenas em crianças, porque estes ácidos não estão completamente desenvolvidos quando estão em crianças. A histidina é utilizada no crescimento e reparação de tecidos. Alguns dos aminoácidos nutricionalmente importantes são a isoleucina, Leucina, Lisina, Metionina, Fenilalanina, Treonina, Triptofano e Valina. Se o corpo não tem isoleucina iria fazer com que o corpo viesse a ter problemas urinários. A treonina ajuda na quebra de ácido úrico no organismo. A valina é uma ajuda importante para o desenvolvimento de tecidos do corpo. Esta é apenas uma explicação de alguns aminoácidos essenciais que são utilizados em todo o corpo.
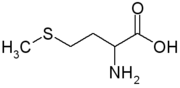
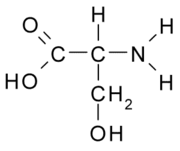
Os aminoácidos não-essenciais são aqueles que podem ser sintetizados pelo organismo. Alguns exemplos desses são alanina, arginina, asparagina, ácido aspártico, ácido glutâmico, glutamina, glicina, prolina, serina e taurina. A arginina é um aminoácido que desempenha um papel na cicatrização de feridas através da remoção de amoníaco a partir do corpo, e na liberação de hormonas. O sistema nervoso usa asparagina, a fim de manter o seu equilíbrio e também na transformação de aminoácidos. A glutamina é utilizada no reforço dos músculos e também está envolvida com a cura do dano celular.[4]
Fora do padrão
Existem dois aminoácidos especiais, que são a pirrolisina e a selenocisteína. Uma selenocisteína está presente em diversas enzimas. Elas não são codificadas diretamente para o código genético ao contrário de outros aminoácidos. Uma pirrolisina é um organismo que é usado para produzir metano. Estes não são os únicos aminoácidos fora do padrão, há realmente muitos diferentes que não são incorporados em uma proteína. Aminoácidos não-padrão são aquelas que ocorrem principalmente nas vias metabólicas dos vinte aminoácidos. Estes aminoácidos não-padrão são apenas versões modificadas dos vinte aminoácidos. [5]
Uso em Proteínas

Os polipeptídeos (e, eventualmente, proteínas) são criadas através da polimerização de ácidos aminados. O produto é o resultado de uma complexa série de reações químicas conhecidas coletivamente como expressão gênica.
Os aminoácidos são ligados um ao outro durante a reação de condensação, que é catalisada por um organelo denominado ribossoma. O ribossoma executa a etapa na expressão do gene conhecido como tradução do ARN mensageiro (ARNm). O ARNm é uma cópia de um gene, que é transportado até um ribossoma onde a sequência de nucleótidos é lida e a informação utilizada para montar o polipéptido.
O ARNm é lido três nucleótidos ao mesmo tempo. Estes curtas sequências de nucleótidos são referidas como códons. Cada códon é informação codificada que o ribossoma traduz em aminoácidos à medida que monta o polipéptido.
Galeria
Alifáticos não polares
Aromáticos não polares
Não polares e descarregados
Polares e descarregados
Ligações externas
- Amino acid Wikipedia
- Amino Acids KWebMarketing
- Amino Acids University of Paisley
| ||||||||||||||